Los recién nacidos de muy bajo peso (RNMBP) y/o los grandes prematuros presentan a menudo desnutrición extrauterina, lo cual repercute en su morbilidad con efectos ya a corto plazo de deficiencias minerales esqueléticas, deficiencias de micronutrientes y pobre crecimiento y ganancia ponderal, y a largo plazo también en un peor neurodesarrollo. Por ello, la alimentación y nutrición óptima del recién nacido (RN) prematuro constituye un auténtico reto para los neonatólogos. El objetivo va a ser proveer de suficiente nutrición para lograr esa velocidad de crecimiento similar a la del útero y obtener resultados funcionales similares a los RN a término. La evidencia científica aconseja una nutrición precoz con incremento de la oferta calórica desde el primer día, y en los RN muy prematuros, que por su inmadurez gastrointestinal no es posible la introducción de una nutrición enteral completa desde el inicio, se recomienda instaurar la nutrición parenteral precozmente desde las primeras horas de vida[1-3].

Doctora María Luz Couce Pico
Fuente: Dra. Couce Pico
El aporte de energía afecta al balance nitrogenado. En los recién nacidos prematuros los requerimientos mínimos de energía son de 50-60 Kcal/Kg/día, pero para favorecer la acreción proteica se precisan 110-130 Kcal/Kg/día. Se considera que se precisan 4-5 Kcal por cada gramo de peso ganado. No obstante, un recién nacido que recibe nutrición parenteral precisa menos calorías que con nutrición enteral, ya que no hay pérdida de energía durante la digestión y los objetivos recomendados en este caso para garantizar el crecimiento y garantizar el aumento de la masa corporal son de 100 Kcal/Kg/día [4]. La distribución de energía habitualmente recomendada es de 45-55% para los carbohidratos, 35-40% para los lípidos y 10-15% para las proteínas.
La glucosa es el principal sustrato energético para el funcionamiento y desarrollo del sistema nervioso central. El paso transplacentario de glucosa en el último trimestre de gestación es de aproximadamente 5 mg/Kg/min. En los RNMBP se recomienda inicialmente un aporte de glucosa de 5-6 mg/Kg/min, con incremento progresivo hasta 8-12 mg/Kg/min. La tasa máxima de metabolización es de aproximadamente 12 mg/Kg/min; aportes mayores van a favorecer la formación de tejido adiposo [5,6]. Además, un aporte excesivo de glucosa puede alterar la función hepática, favoreciendo la esteatosis y colestasis. El balance entre carbohidratos y lípidos es necesario para la acreción proteica y evitar la oxidación de proteínas que puede ocurrir cuando se aportan concentraciones muy altas de glucosa sin un aporte suficiente de lípidos. Las recomendaciones actuales indican un aporte de glucosa que cubra el 60-75% de los aportes calóricos no proteicos (50 % Kcal totales).
Se recomiendan aportes de aminoácidos de 1.5-2.5 g/Kg/día desde el primer día, ya que previenen el catabolismo y el balance nitrogenado negativo, inducen un balance nitrogenado positivo y acreción proteica y favorecen la ganancia de peso y del crecimiento. Se deben aumentar en 2-4 días hasta 3.5g/kg/día. Las soluciones de AA parenterales deben contener una adecuada proporción de aminoácidos esenciales (valina, leucina, isoleucina, treonina, fenilalanina, metionina, lisina, histidina, triptófano) y no esenciales; con más baja concentración de los aminoácidos potencialmente tóxicos (tirosina, fenilalanina, metionina) y más elevada de otros como lisina y treonina, reguladores de la velocidad de síntesis proteica [7]. Además, deben contener aminoácidos semiesenciales: tirosina, cisteína/cistina y taurina.
Los lípidos proveen energía y ácidos grasos esenciales, precisos para el crecimiento y neurodesarrollo. El RN prematuro, por su rápido crecimiento y bajas reservas de ácidos grasos, es muy vulnerable a la deficiencia de ácidos grasos esenciales. Deben recibir emulsiones lipídicas ya desde las primeras 48 horas de vida con un aporte inicial en los < 1000 g peso a 0.5-1 g/kg/día y en los > 1000 g peso a 2 g/kg/día [8]. Se aumenta en los primeros días de vida hasta un máximo aporte de 3 g/kg/día. Se aconseja reducir el aporte de lípidos si los triglicéridos en sangre están en >250 mg/dL. En determinadas circunstancias, hay que tener precaución y reducir el aporte de lípidos garantizando la administración de ácidos grasos esenciales (0,5-1 g/kg/día) [4]:
• Infecciones graves.
• Hiperbilirrubinemia neonatal.
• Trombocitopenia <100.000/mm3.
• Insuficiencia hepática.
• Enfermedades pulmonares.
Fuente: Archivo
El uso de emulsiones lipídicas que tienen aceite de pescado en su composición pueden ser beneficiosas para el estado de DHA, retinopatía del prematuro, estrés oxidativo e hipertensión pulmonar [9-12].
Las recomendaciones actuales de calcio y fósforo para garantizar el crecimiento son:
• 1.3-3 mmol/Kg/día de Ca
• 1-2.3 mmol/Kg/día de P con un cociente Ca/P: 1.3-1.7.
En los primeros días de vida, con el uso de la nutrición parenteral del día 0 con niveles de proteínas de 2 g/Kg/día puede considerarse aportar un ratio Ca: P próximo a 1 a fin de evitar las situaciones de hipofosfatemia frecuentemente descritas [13].
La homeostasis del calcio es controlada en parte por el magnesio, el cual tiene un papel importante en el mantenimiento del potencial eléctrico de nervios y membranas celulares. El aporte de Na+, K+ y Cl- (Tabla 1) [14]:
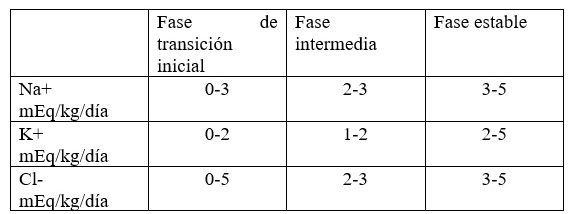
Tabla 1. Aporte de electrolitos
El aporte de oligoelementos se administra en la parenteral mediante soluciones de aminoácidos IV específicos como la Solución de oligoelementos®: Composición por ml: Zn 200 µg, Cu 20 µg, Cr 0,2 µg, Mn 10 µg, Se 3 µg. En general, se administra 0.1 ml/Kg de la solución de oligoelementos. Algunos pacientes pueden precisar más aporte de zinc, pues los prematuros tienen unas necesidades de zinc de 400 µg/kg/día.
También existen soluciones de vitaminas intravenosas (IV) específicas como:
-Infuvite Pediátrico®: RNPT <1 kg peso 1,5 mL; 1-3 kg peso 3 mL, aporta todas las vitaminas necesarias.
-Soluvit® y Vitalipid®: 1,5 y 4 ml/kg/día de cada uno de los preparados, aportan todas las vitaminas hidrosolubles y liposolubles respectivamente.
-Cernevit®: 1,3 ml/kg/día; suplementar la vitamina K.
El aporte de líquidos debe realizarse con un ajuste muy cuidadoso (Tabla 2)

Tabla 2. Fluidoterapia
Las fórmulas de Nutrición parenteral estandarizadas y bien balanceadas pueden ser una alternativa para uniformar el manejo nutricional del RNMBP.
La nutrición parenteral debe mantenerse hasta que sea posible administrar al menos las necesidades basales calóricas mediante nutrición enteral.
Los recién nacidos prematuros están dotados de un tracto digestivo inmaduro, en fase de crecimiento, y en su etapa inicial de la vida se va a producir además el establecimiento de la microbiota. El inicio precoz de la administración de una nutrición enteral mínima favorecerá el establecimiento de dicha microbiota saludable, evitará la atrofia y facilitará la maduración intestinal y la nutrición digestiva.
Los requerimientos nutricionales por vía enteral quedan reflejados en la Tabla 3
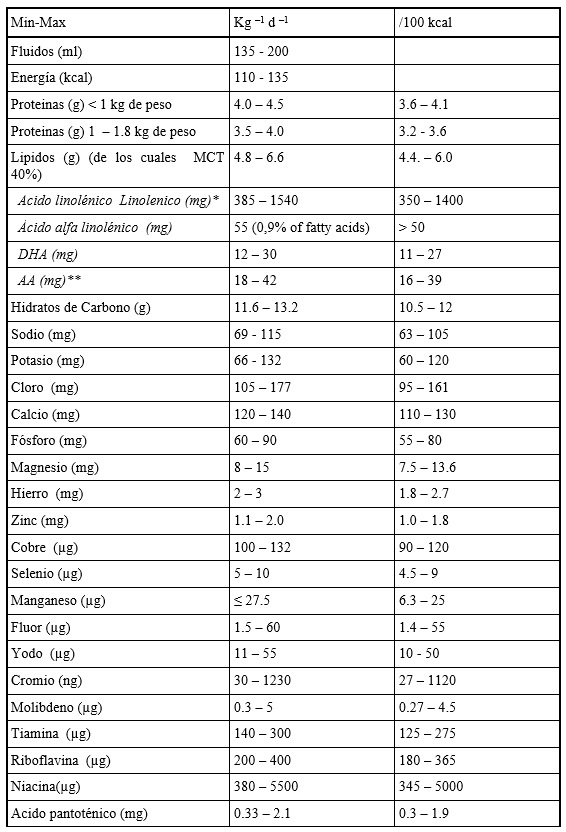
![Tabla 3. Recomendaciones de la ESPGHAN 2010 de aportes recomendados de macro y micronutrientes expresados en mg/kg/día y por 100 Kcal (excepto indicado de otra forma) [15]. * El ratio ácido linoleico / alfa linolénico es 5-15:1 . ** El ratio de AA:DHA debería estar en el rango de 1.0-2.0:1, y el aporte de ácido eicosapentaenoico (20:5n-3) no debería exceder el 30% del aporte de DHA tabla 3 b2 Recomendaciones de la ESPGHAN](http://farmacosalud.com/wp-content/uploads/2017/10/tabla-3-b2-Recomendaciones-de-la-ESPGHAN1.jpg)
Tabla 3. Recomendaciones de la ESPGHAN 2010 de aportes recomendados de macro y micronutrientes expresados en mg/kg/día y por 100 Kcal (excepto indicado de otra forma) [15]. * El ratio ácido linoleico / alfa linolénico es 5-15:1 . ** El ratio de AA:DHA debería estar en el rango de 1.0-2.0:1, y el aporte de ácido eicosapentaenoico (20:5n-3) no debería exceder el 30% del aporte de DHA.
En RNPT < 32 semanas o < 1500 gramos estables hemodinámicamente se recomienda iniciar la alimentación enteral trófica, que es la administración de pequeños volúmenes de leche (10-25 ml/kg/día) poco después del nacimiento, en el 1º-2º día de vida. Tras un período de nutrición enteral trófica, en RN prematuros estables con peso al nacer 1000-1500 puede aumentarse 20-40 ml/kg/día y en RN prematuros < 1000g o con retraso de crecimiento intrauterino 20-25 ml/kg/día.
La administración precoz de calostro oral (en cuanto la madre lo produce) es una estrategia protectora recientemente implantada. Los estudios al respecto realizados en RNMBPN, han mostrado que la alimentación precoz de calostro puede influir en la colonización microbiana de la cavidad oral, disminuir la sepsis clínica, disminuir la secreción de citokinas proinflamatorias, aumentar los niveles de factores protectores inmunológicos, aumentar el peso a las 36 semanas de EGC y acortar la estancia hospitalaria. Las dosis utilizadas en los estudios oscilan entre 100 microlitros en cada mejilla cada 6 h durante 5 -7 días, hasta 0.2 ml hasta la semana 32 de edad postmenstrual.
Existen varias opciones para administrar la alimentación y poca evidencia de cuál es la forma ideal de hacerlo. La alimentación en bolo por declive cada 2-3 horas, en gastroclisis intermitente en 1 o 2 horas, cada 2-3 horas, o en administración continua. Se ha descrito una disminución del aporte graso y calórico con la administración continua, por adherencia de lípidos al sistema de alimentación. En el subgrupo de los niños más inmaduros (peso al nacer < 1250 y < 29 SG) hay evidencia de que la alimentación por gastroclisis continua se asocia a mayor ganancia ponderal y a alcanzar antes la nutrición enteral completa que la alimentación con bolos.

Fuente: ICFO (Archivo)
Un reciente metanálisis de la Cochrane no encuentra evidencia suficiente para indicar uno u otro método; sin embargo, recomienda en los de PN < 1250 la alimentación en gastroclisis continua por permitir alcanzar una nutrición enteral completa y el alta más precozmente.
El patrón de oro de la alimentación de cualquier lactante es la leche materna, también en el caso de los recién nacidos prematuros, para los que aporta una serie de beneficios adicionales. En aquellas ocasiones en las que la madre no desee dar LM, o no pueda dar LM de forma total o parcial, en algunos centros existe la posibilidad de dar leche materna donada, que se considera la mejor alternativa. La siguiente opción es la fórmula de prematuros.
Los fortificantes con multicomponentes para leche materna se han diseñado para suplementar la leche materna en energía, proteínas, calcio, fósforo, vitaminas, y en ocasiones, hierro. Están indicados en RN ≤32 SG o PN < 1500 gramos o en prematuros algo más mayores que no toleran aportes elevados de leche materna (≥ 180ml/kg/día). No existe evidencia sobre el momento óptimo de iniciar la fortificación. Ha sido pauta habitual iniciarla tras alcanzar los 80ml/kg de LM, de forma progresiva o completa desde el inicio. Estudios más recientes inician la fortificación desde aportes de 40-50 ml/kg/día.
Bibliografía
1. Senterre T, Rigo J. Optimizing early nutritional support based on recent recommendations in VLBW infants and postnatal growth restriction. J Pediatr Gastroenterol Nutr 2011; 53:536-42
2. De Curtis M, Rigo J. The nutrition of preterm infants. Early Human Development 2012; 88: S5-7.
3. Stephens BE, Walden RV, Gargus RA, Tucker R, McKinley L, Mance M, Nye J, Vohr BR. First-week protein and energy intakes are associated with 18-month developmental outcomes in extremely low birth weight infants. Pediatrics 2009; 124: 649-57
4. Koletzko B, Goulet O, Hunt J, Krohn K, Shamir R: 1. Guidelines on Paediatric Parenteral Nutrition of the European Society of Paediatric Gastroenterology, Hepatology and Nutrition (ESPGHAN) and the European Society for Clinical Nutrition and Metabolism (ESPEN), Supported by the European Society of Paediatric Research (ESPR). J Pediatr Gastroenterol Nutr 2005;41 Suppl 2:S1-87.
5. Bier DM, Brosnan JT, Flatt JP, Hanson RW, Heird W, Hellerstein MK, Jequier E, Kalhan S, Koletzko B, Macdonald I, Owen O, Uauy R: Report of the IDECG Working Group on lower and upper limits of carbohydrate and fat intake. International Dietary Energy Consultative Group. Eur J Clin Nutr 1999; 53 Suppl 1:S177-S178.
6. Sunehag AL, Haymond MW, Schanler RJ, Reeds PJ, Bier DM: Gluconeogenesis in very low birth weight infants receiving total parenteral nutrition. Diabetes 1999; 48:791-800.
7. Hay WW, Thureen P: Protein for preterm infants: how much is needed? How much is enough? How much is too much? Pediatr Neonatol 2010; 51:198-207.
8. Vlaardingerbroek H, van Goudoever JB. Intravenous lipids in preterm infants: impact on laboratory and clinical outcomes and long-term consequences. World Rev Nutr Diet 2015; 112:71-80.
9. D'Ascenzo R, D'Egidio S, Angelini L, et al. Parenteral nutrition of preterm infants with a lipid emulsion containing 10% fish oil: effect on plasma lipids and long-chain polyunsaturated fatty acids. J Pediatr 2011; 159:33-38
10. Pawlik D, Lauterbach R, Turyk E. Fish-oil fat emulsion supplementation may reduce the risk of severe retinopathy in VLBW infants. Pediatrics. 2011; 127:223-228.
11. Skouroliakou M, Konstantinou D, Koutri K, et al. A double-blind, randomized clinical trial of the effect of omega-3 fatty acids on the oxidative stress of preterm neonates fed through parenteral nutrition. Eur J Clin Nutr. 2010; 64:940-947.
12. Houeijeh A, Aubry E, Coridon H, et al. Effects of n-3 polyunsaturated fatty acids in the fetal pulmonary circulation. Crit Care Med. 2011; 39: 1431-1438.
13. Electrolyte and Mineral Homeostasis After Optimizing Early Macronutrient Intakes in VLBW Infants on Parenteral Nutrition. Senterre T, Abu Zahirah I, Pieltain C, de Halleux V, Rigo J.
14. Grupo de Nutrición y Metabolismo de la SENeo. Nutrición parenteral en el recién nacido de muy bajo peso. Ergón 2017. ISBN: 978-84-16732-82-1
15. Agostoni C, Buonocore G, Carnielli VP, De Curtis M, Darmaun D, Decsi T, et al: Enteral nutrient supply for preterm infants: commentary from the European Society of Paediatric Gastroenterology, Hepatology and Nutrition Committee on Nutrition. J Pediatr Gastroenterol Nutr 2010; 50: 85–91.




