Redacción Farmacosalud.com
La placenta es un órgano efímero que relaciona al embrión en desarrollo con la madre, satisfaciendo las necesidades de respiración, nutrición y expulsión del feto. Científicos del Instituto de Investigación Biomédica (IRB Barcelona) revelan por primera vez que el gen TLK2 es indispensable para el desarrollo de la placenta y la viabilidad del embrión, en ratones. Los resultados se han publicado en la revista del grupo Nature, ‘Cell Death and Differentiation’. A pesar de las diferencias entre el desarrollo embrionario de ratones y humanos, este hallazgo podría tener relevancia biomédica. Datos clínicos recientes obtenidos de un análisis genómico masivo desarrollado en Estados Unidos con personas con discapacidad intelectual, detectó mutaciones en 10 nuevos genes de los pacientes, entre los cuales se incluye TLK2.
Travis H. Stracker, científico del IRB Barcelona y líder del estudio, explica que “especulamos que en humanos las mutaciones en el gen TLK2 pueden resultar en disfuncionalidad de la placenta durante el desarrollo embrionario –por ejemplo, que no llegue suficiente oxígeno– y provoque desórdenes neurológicos.” En ratones sin TLK2, el embrión es más pequeño pero los investigadores no observan defectos morfológicos y la placenta también es más pequeña. Son los fallos en la placenta la causa de la muerte del embrión a los 15 días de los 20 de gestación. Los científicos detectan una reducción en la expresión de genes importantes para la proliferación o supervivencia de trofoblastos -grupo de células especializadas que provee nutrientes al embrión- con efectos en la funcionalidad de la placenta.
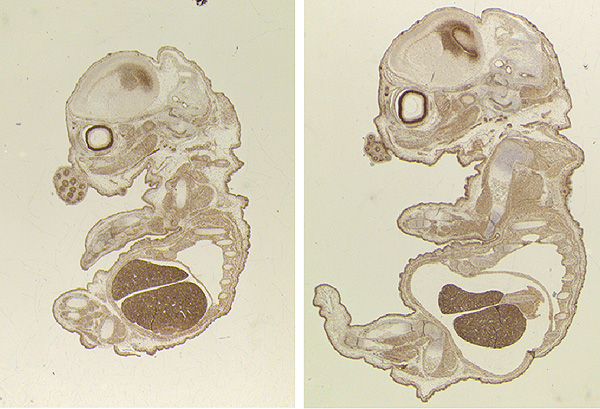
Comparativa del desarrollo embrionario de ratones -control y sin TLK2 (izquierda)-. El desarrollo es más lento pero morfológicamente normal
(S. Segura-Bayona, IRB Barcelona)
Fuente: IRB Barcelona
En este mismo trabajo, los científicos también revelan que TLK2 es, en cambio, totalmente dispensable en ratones adultos. Su función la suple su gen ‘gemelo’, TLK1. La ausencia de uno u otro gen se compensa por la presencia del otro, y los animales son aparentemente normales, saludables y tiene la misma esperanza de vida. “Sólo cuando eliminamos los dos genes a la vez vemos problemas de inestabilidad genómica, segregación de cromosomas y complicaciones de este tipo”, resume la estudiante de doctorado de ‘la Caixa’ en el IRB Barcelona, Sandra Segura-Bayona, primera autora del estudio junto al investigador postdoctoral Philip Knobel y Helena González Burón, quien inició este estudio también con una beca de ‘la Caixa’ en 2011, y cuyos resultados de su tesis también se incluyen en este artículo. Los investigadores concluyen que ambos genes mantienen la integridad genómica y la viabilidad celular y que sus funciones en adultos son redundantes.
TLK1 y TLK2 podrían ser dianas de terapias anticáncer
En el apartado del cáncer, se sabe que TLK2 está aumentado en un subtipo de tumor de mama y que dicho aumento está implicado en la progresión del cáncer. Además, es conocido que tanto TLK1 como TLK2 están involucrados en la proliferación celular y que probamente dicha actividad de ambos genes es necesaria para la progresión de las células tumorales. En base a este conocimiento, se especula que tanto TLK1 como TLK2 podrían ser diana de terapias anticáncer.
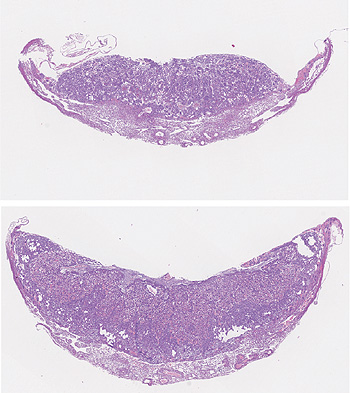
Comparativa del desarrollo de la placenta -control y sin TLK2 (arriba)-. El desarrollo de la placenta sin TLK2 es defectuoso y es la causa de la muerte del embrión a los 15 días de gestación
(S. Segura-Bayona, IRB Barcelona)
Fuente: IRB Barcelona
Con el fin de avanzar en esta línea, el laboratorio de Travis H. Stracker, dedicado a estudiar la relación entre Inestabilidad Genómica y Cáncer, está poniendo a punto inhibidores de TLK1 y TLK2 para estudiar las funciones de estos genes en modelos animales de cáncer.
El trabajo sobre TLK2 y su relación con la placenta se ha realizado en colaboración con investigadores de la Universidad de Utrecht en Holanda, del Princess Margaret Cancer Center de Toronto en Canadá y de la Universidad de Copenhague en Dinamarca. El estudio ha recibido financiación del Ministerio de Economía y Competitividad a través de fondos europeos Feder.
Artículo de referencia:
Sandra Segura-Bayona, Philip A Knobel, Helena González-Burón, Sameh A Youssef, Aida Peña-Blanco, Étienne Coyaud, Teresa López-Rovira, Katrin Rein, Lluís Palenzuela, Julien Colombelli, Stephen Forrow, Brian Raught, Anja Groth, Alain de Bruin, and Travis H Stracker. ‘Differential requirement for Tousled-like kinases 1 and 2 in mamalian development’. Cell Death and Differentiation (2017): doi: 10.1038/cdd.2017.108




