Redacción Farmacosalud.com
La compañía Novartis ha anunciado que RTH258 (brolucizumab) 6 mg cumplió los principales objetivos primarios y secundarios en dos estudios de Fase III, HAWK y HARRIER. RTH258 3 mg, evaluado en HAWK, también cumplió dichos objetivos. Dichos estudios clínicos reclutaron a más de 1.800 pacientes con degeneración macular asociada a la edad (DMAE) neovascular en 400 centros de todo el mundo. Los principales objetivos primarios y secundarios de eficacia eran la no inferioridad de RTH258 frente a aflibercept en el cambio medio en la mejor agudeza visual corregida (MAVC) desde el valor basal hasta la semana 48 y el cambio medio en el período entre las semanas 36-48, respectivamente.[3,4] Ambos se cumplieron con valores p muy significativos. En general, RTH258 se toleró bien con una tasa global de acontecimientos adversos oculares y no oculares (sistémicos) comparable a la de aflibercept.[1,2]
RTH258 demostró una eficacia duradera frente a aflibercept a intervalos de ocho semanas. La mayoría de los pacientes, 57% (HAWK) y 52% (HARRIER), se mantuvieron exclusivamente a intervalos de 12 semanas inmediatamente después de la fase de carga hasta la semana 48.[1,2] Hay un análisis detallado de los datos en proceso que se presentará en un futuro congreso médico. RTH258 es un anticuerpo de cadena sencilla muy innovador que permite alcanzar concentraciones mucho más altas de anticuerpos en el ojo que las terapias aprobadas. Dada la complejidad de la fórmula, Novartis ha invertido para garantizar una fórmula competitiva de bajo coste en los últimos 18 meses para optimizar el valor a largo plazo de RTH258. Novartis espera completar el estudio farmacocinético con el proceso de fabricación final para presentar la solicitud de registro en 2018.
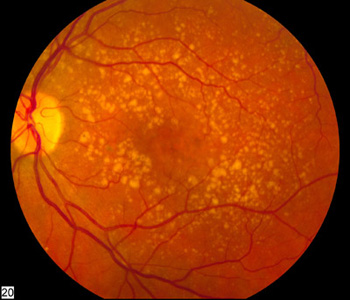
Fondo de ojo que muestra una degeneración macular intermedia
Fuente: National Eye Institute of the NIH, http://www.nei.nih.gov/photo/eyedis/images/EDA22_72.jpg
Wikipedia
26 kDa, con inhibición potente y alta afinidad con todas las isoformas de VEGF-A
RTH258 tiene potencial para abordar las necesidades de los pacientes con DMAE neovascular, que se beneficiarían de un tratamiento duradero y eficaz con un régimen de dosis menos frecuente.[5] RTH258, diseñado específicamente para el ojo, es el fragmento de anticuerpo de cadena sencilla humanizado más avanzado clínicamente en desarrollo. Su innovadora arquitectura da lugar a una pequeña molécula (26 kDa) con inhibición potente y alta afinidad con todas las isoformas de VEGF-A.[6,7] Entre los posibles beneficios de su pequeño tamaño figuran la mejor penetración en el tejido y la rápida eliminación de la circulación sistémica.[6,8,9] En estudios preclínicos,[6-9] RTH258 inhibió la activación de receptores de VEGF previniendo las interacciones ligando-receptor. El aumento de la señalización a través de la vía de VEGF se asocia a angiogénesis ocular patológica y edema retiniano[10]. Se ha demostrado que la inhibición de la vía de VEGF inhibe el desarrollo de lesiones neovasculares, resuelve cura el edema retiniano y mejora la visión en pacientes con enfermedades vasculares coriorretinianas.[11]
Con más de 1.800 pacientes de 400 centros en todo el mundo, HAWK y HARRIER son los primeros y únicos ensayos globales simultáneos en pacientes con DMAE neovascular que han demostrado prospectivamente su eficacia con un intervalo entre inyecciones previsto de 12 semanas.[1,2] Ambos son estudios de 96 semanas prospectivos, aleatorizados, con doble enmascaramiento y multicéntricos y forman parte del desarrollo clínico de Fase III de RTH258.[3,4]
Los estudios se diseñaron para comparar la eficacia y seguridad de inyecciones intravítreas de RTH258 6 mg y 3 mg (sólo en HAWK) frente a aflibercept 2 mg en pacientes con DMAE neovascular.[3,4] El objetivo primario de eficacia de los ensayos HAWK y HARRIER era confirmar que RTH258 no era inferior a aflibercept en el cambio medio de la mejor agudeza visual corregida (MAVC) desde el valor basal hasta la semana 48.[3,4] Los objetivos secundarios incluyen cambio medio en la MAVC desde el valor basal en las semanas 36-48, la proporción de pacientes con inyecciones en un intervalo de 12 semanas en la semana 48 y parámetros anatómicos.[3,4]
“Brolucizumab compensará la tendencia actual al infra-tratamiento"
En ambos protocolos, los pacientes fueron aleatorizados a RTH258 o aflibercept. Inmediatamente después de la fase de carga de 3 meses, los pacientes del grupo de RTH258 recibieron la dosis a un intervalo de 12 semanas con la opción de ajustarlo a 8 semanas en función de las valoraciones enmascaradas de actividad de la enfermedad en visitas definidas. Aflibercept se administró una vez cada dos meses conforme a las recomendaciones.[3,4] RTH258 6 mg cumplió sus principales objetivos primarios y secundarios en dos estudios de Fase III, HAWK y HARRIER. RTH258 3 mg, evaluado en HAWK, también cumplió dichos objetivos. En ambos estudios, los objetivos se cumplieron con p muy significativa.[1,2]
(Imagen modificada) Autor/a del original: Alvimann
Fuente: morguefile.com (free image)
En palabras del Dr. Jordi Monés, uno de los expertos españoles, participantes en el estudio HARRIER, Director Institut de la Màcula, Teknon Medical Center, y Director Médico de la Macula Foundation: Research for Vision: “No necesitamos tratamientos más eficaces, lo que necesitamos es reducir la carga de tratamiento, inyectando lo necesario para conseguir los resultados óptimos. Con menos inyecciones conseguiremos la misma eficacia y mejoraremos los resultados clínicos. Brolucizumab compensará la tendencia actual al infra-tratamiento". Por su parte, el Dr. José J. Escobar, jefe de servicio de Oftalmología en el hospital Dos de Maig en Barcelona, apunta que "Brolucizumab marcará el futuro en el tratamiento de la retina médica. Tras la dosis de carga, una inyección es suficiente para cada estación del año, así que una vez por todas, brolucizumab puede acabar con la sobrecarga asistencial".
La DMAE neovascular afecta a 20-25 millones de personas en todo el mundo
La Dra. Laura Sararols, jefa del servicio de oftalmología del Hospital Universitario General de Cataluña, añade: “Estoy segura de que brolucizumab es el nuevo fármaco que todos estamos esperando. La DMAE exudativa se controlará cada 3 meses en muchos casos, con menos inyecciones y menos visitas, beneficiándonos a todos, pacientes y médicos. Tras trabajar con brolucizumab desde la Fase I y ahora terminar la Fase III, estoy convencida que este fármaco nos va a hacer sentir cómodos con la inyección intravítrea cada 3 meses. Nuestros pacientes con DMAE exudativa estarán protegidos frente a recidivas durante más tiempo y con menos inyecciones”.
La DMAE neovascular es la principal causa de pérdida de visión grave y ceguera legal en personas mayores de 65 años en Norteamérica, Europa, Australia y Asia, y se estima que afecta a 20-25 millones de personas en todo el mundo.[12,13] La DMAE neovascular se produce cuando se forman vasos sanguíneos anormales que crecen bajo la mácula, la zona de la retina responsable de la visión aguda central. Dichos vasos sanguíneos son frágiles y sueltan fluidos y sangre, perturbando la arquitectura retiniana normal y, finalmente, provocando daños en las células sensibles a la luz.[14,15] Los primeros síntomas de la DMAE neovascular son visión distorsionada o metamorfopsia y problemas para ver los objetos claramente.[16] El diagnóstico e intervención temprana son esenciales. A medida que la enfermedad avanza, los daños celulares aumentan, reduciendo la calidad de la visión. Esto puede provocar una pérdida total de visión central, por lo que el paciente no puede leer, conducir ni reconocer caras conocidas.[14] Sin tratamiento, la visión puede deteriorarse en cuestión de días.[17]
Referencias
1. Data on file.
2. Data on file.
3. ClinicalTrials.gov. Identifier NCT02307682. Available at https://clinicaltrials.gov/ct2/show/NCT02307682. Accessed June 2017.
4. ClinicalTrials.gov. Identifier NCT02434328. Available at https://clinicaltrials.gov/ct2/show/NCT02434328. Accessed June 2017.
5. Prenner JL, et al. Disease Burden in the Treatment of Age-Related Macular Degeneration: Findings From a Time-and-Motion Study. American Journal of Ophthalmology. 2015;160(4):725-731.e1.
6. Escher D, Schmidt A, STeiner P, Maurer P, Weissgerber G. Single-chain antibody fragments in ophthalmology. Oral presentation at EURETINA congress. 2015. Abstract. Available at: http://www.euretina.org/nice2015/programme/free-papers-details.asp?id=4072&day=0 (accessed 16 May 2017)
7. Tietz J, Spohn G, Schmid G, et al. Affinity and Potency of RTH258 (ESBA1008), a Novel Inhibitor of Vascular Endothelial Growth Factor A for the Treatment of Retinal Disorders. IOVS. 2015; 56(7): 1501. http://iovs.arvojournals.org/article.aspx?articleid=2331210.
8. Nimz EL, Van't Land CW, Yanez JA, Chastain JE. Intraocular and systemic pharmacokinetics of brolucizumab (RTH258) in nonhuman primates. The Association for Research in Vision and Ophthalmology (ARVO) annual meeting. 2016. Abstract 4996. http://www.arvo.org/webs/am2016/sectionpdf/RC/Session_443.pdf
9. Gaudreault J, Gunde T, Floyd HS, et al. Preclinical pharmacology and safety of ESBA1008, a single-chain antibody fragment, investigated as potential treatment for age related macular degeneration. ARVO Annual meeting abstract. Invest Ophthalmol Vis Sci 2012;53:3025. http://iovs.arvojournals.org/article.aspx?articleid=2354604
10. Qazi Y, et al. Mediators of ocular angiogenesis. J. Genet. 2009;88(4):495-515.
11. Kim R. Introduction, mechanism of action and rationale for anti-vascular endothelial growth factor drugs in age-related macular degeneration. Indian J Ophthalmol. 2007;55(6):413-415.
12. Schmidt-Erfurth U, et al. Guidelines for the management of neovascular age-related macular degeneration by the European Society of Retina Specialists (EURETINA). Br J Ophthalmol. 2014;98:1144-1167.
13. Chopdar A et al. Age related macular degeneration. BMJ. 2003;26(7387):485-488.
14. World Health Organization. Priority eye diseases: Age-related macular degeneration. Available at http://www.who.int/blindness/causes/priority/en/index7.html. Accessed June 2017.NHS Choices. Macular Degeneration. Available at http://www.nhs.uk/Conditions/Macular-degeneration/Pages/Introduction.aspx. Accessed June 2017.
15. National Eye Institute. Facts About Age-Related Macular Degeneration. Available at https://nei.nih.gov/health/maculardegen/armd_facts. Accessed June 2017
16. NHS Choices. Macular degeneration – Symptoms. Available at http://www.nhs.uk/Conditions/Macular-degeneration/Pages/Symptoms.aspx. Accessed June 2017.
17. van Lookeren Campagne M, et al. Mechanisms of age-related macular degeneration and therapeutic opportunities. J Pathol. 2014; 232(2):151-64. doi: 10.1002/path.4266.




