Dr. Josep Manel Casanova Seuma
(el Dr. Casanova declara no tener conflicto de intereses)
La psoriasis es una dermatosis inflamatoria crónica cutánea, de causa no bien definida, aunque probablemente genética, que afecta a un 1-3% de la población de los países occidentales (1,7% en España)[1]. Se caracteriza por placas de color rojo intenso que se localizan típicamente en codos, rodillas, región sacra y cuero cabelludo, que se pueden extender y ocupar gran parte del tegumento. Se asocia a artritis, en ocasiones incapacitante, en un 10-20% de los casos, y a otras comorbilidades como síndrome metabólico en cerca de un tercio de los pacientes[1], con el consiguiente riesgo cardiovascular que ello conlleva. Además de sus comorbilidades sistémicas, la incapacidad que genera la propia enfermedad (dolor, tirantez, quemazón) y los trastornos psicológicos (ansiedad, depresión, falta de autoestima), que acompañan en especial a las formas graves, hace que sea considerada por los dermatólogos y percibida por los mismos pacientes como una de las enfermedades crónicas con mayor repercusión, comparable a la de las cardiopatías o a algunas formas de cáncer[2].

Doctor Josep Manel Casanova Seuma
Fuente: Dr. Casanova
Por suerte, la mayoría de pacientes con psoriasis padecen formas leves, localizadas, de la enfermedad y se controlan con diferentes tratamientos tópicos como las pomadas de corticoides, los análogos de la vitamina D, los derivados purificados de los alquitranes y la antralina, además de cremas hidratantes y baños de sol en verano. Ahora bien, cerca del 20% tienen formas moderadas o graves de la enfermedad (BSA>10, PASI>10 y DLQI>10) y precisan tratamientos más potentes: fototerapia (UVB o PUVA), fármacos sistémicos clásicos (acitretino, metotrexato y ciclosporina) o inmunosupresores biológicos.
Los fármacos sistémicos tradicionales pueden tener efectos secundarios graves, especialmente de tipo acumulativo y órgano-específico (acitretina – dislipemia; metotrexate – daño hepático; ciclosporina - daño renal), lo que limita la duración del tratamiento y ha originado la búsqueda incesante de nuevos fármacos.
Se cumplen dos décadas de la irrupción de los nuevos fármacos antiinflamatorios e inmunosupresores selectivos denominados 'biológicos'. Se trata de fármacos diseñados mediante ingeniería genética y compuestos por anticuerpos monoclonales contra diversas dianas moleculares que se sitúan en el centro de la reacción inmuno-inflamatoria que caracteriza a la psoriasis. Son los fármacos anti-TNF-α como etanercept (ETN), infliximab (IFX) o adalimumab (ADM), anti-IL-23 como ustekinumab (UTK) y anti-IL-17, como secukinumab (SCM) e ixekinumab (IXE).
Se ha comprobado que los biológicos son fármacos con pocos efectos adversos. Ahora bien, existen dos factores que limitan su uso: la todavía corta experiencia respecto a sus efectos secundarios a largo plazo y su elevado coste[3]. De momento, entre los efectos secundarios conocidos destaca la inmunosupresión y por tanto el riesgo de infecciones graves, incluso por gérmenes oportunistas, y el cáncer, en especial linfomas.
Por ello, la Agencia Europea para la Evaluación de Medicamentos (European Medicines Evaluation Agency, EMEA) estableció unos criterios que deben cumplir los pacientes antes de indicar los tratamientos y que aún perduran para los anti-TNF:
1) Pacientes adultos con psoriasis crónica en placas moderada-grave (PASI>10, BSA>10 y DLQI>10)
2) que no hayan respondido o esté contraindicado el tratamiento con los fármacos sistémicos clásicos (ciclosporina, metotrexate, acitretino) o con fototerapia UVB o PUVA, excluyendo a individuos con antecedentes de neoplasias internas o melanoma, y aquellos con historia de infección oportunista o recurrente clínicamente significativa, aunque para los nuevos biológicos sólo es necesario que no hayan respondido a tratamientos sistémicos convencionales.
Estimación de la gravedad (intensidad) de la psoriasis
Normalmente se tienen en cuenta 3 parámetros:
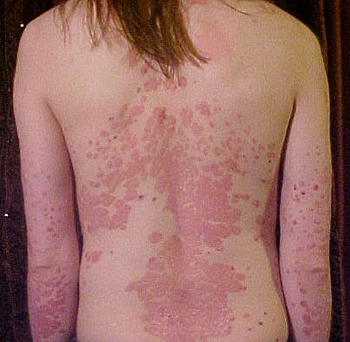
Un ejemplo de psoriasis
Autor/a de la imagen: User:The Wednesday Island (of the English Wikipedia) derivative work: James Heilman, MD (talk) - Psoriasis_on_back.jpg
Fuente: Wikimedia Commons
-BSA (Body Surface Area). Superficie corporal afectada. Se calcula por la regla de los 9, similar a la afectación de un quemado. Un BSA ≥10 indica que la psoriasis es moderada-grave, ya que la superficie afectada comprende al menos el 10% del tegumento.
-PASI (Psoriasis Area Severity Index). Contempla tanto el área afectada, como el grosor de las placas, la intensidad del eritema y el grado de descamación. Un PASI ≥10 indica que la psoriasis es moderada-grave. Un PASI75, significa una reducción de un 75% en la intensidad de la psoriasis y es la medida estándar de la efectividad de un tratamiento.
-DLQI (Dermatology Life Quality Index). Cuestionario de calidad de vida referido a las discapacidades físicas y psíquicas que causa una determinada dermatosis. Referido a la psoriasis, un DLQI ≥10 indica que la psoriasis repercute de manera importante sobre la calidad de vida del paciente que la sufre.
Por su efectividad, tolerancia y rapidez de acción, los fármacos biológicos se utilizan igualmente en muchas enfermedades inflamatorias autoinmunes (artritis reumatoide, espondilitis, uveítis, colitis ulcerosa y enfermedad de Crohn). Existen pequeñas diferencias entre ellos respecto al mecanismo de acción, vía de administración y eficacia. Actúan contra una diana molecular determinada, por lo que su especificidad puede evitar los efectos secundarios de los tratamientos sistémicos tradicionales. Suelen administrarse en forma de monoterapia[4] y, si no se obtiene respuesta al cabo de 12-16 semanas o ésta es insuficiente (PASI<50%), es preferible cambiarlo por otro sistémico o biológico o bien combinarlos con otros fármacos.
Antes de comenzar el tratamiento con este tipo de fármacos debemos descartar la existencia de infecciones concomitantes, en especial tuberculosis, neoplasias en los últimos 5 años y esclerosis múltiple, por lo que se recomienda realizar una historia clínica exhaustiva, una analítica de sangre con serologías para VHB, VHC y VIH, un PPD o cuantiferón y una radiografía de tórax. No es necesario realizar tests de laboratorio para el seguimiento rutinario de este tipo de tratamiento[5].
La efectividad de todos estos fármacos ha sido comprobada en múltiples ensayos aleatorizados y controlados con placebo que han incluido a varios miles de pacientes. Además de la psoriasis, se emplean ampliamente y con éxito en el tratamiento de las formas moderadas y graves de artritis psoriásica y reumatoide, artritis reumatoide juvenil, espondilitis anquilopoyética y enfermedad inflamatoria intestinal. Describiremos algunas de sus características esenciales.
1. FÁRMACOS BIOLÓGICOS ANTI-TNF-α
a. INFLIXIMAB (Remicade®)
Fue uno de los primeros monoclonales comercializados y se utiliza por vía endovenosa. La dosis de inducción recomendada para el tratamiento de la psoriasis es de 5 mg/kg de peso, en las semanas 0, 2 y 6, para pasar luego como mantenimiento a una infusión cada 8 semanas hasta que se consigue el blanqueamiento de la psoriasis. Dado que puede causar reacciones agudas graves, el fármaco debe administrarse bajo control médico. Proporciona un PASI-75 (mejora de la gravedad de la psoriasis de un 75%) en un 75-88% de los pacientes al cabo de 10 semanas[6,7]. Recientemente ha expirado la patente de infliximab, lo que ha permitido la comercialización del biosimiar Remsina® (CT-P13) e Inflectra®, que han demostrado una efectividad equiparable[8,9].

(Imagen modificada) Autor/a del original: nacu
Fuente: morguefile.com (free)
b. ETANERCEPT (Enbrel®)
Se utiliza por vía subcutánea. Se dispensa en jeringas precargadas que se inyecta el propio paciente de manera rotatoria en la grasa subcutánea del abdomen o los muslos. La dosis de inducción es de 100 mg semanales durante los primeros 3 meses. A partir del cuarto mes se administran 50 mg semanales como tratamiento de mantenimiento[10,11]. Su máxima eficacia se consigue a los 6 meses y proporciona un PASI-75 entre el 47-59% de los pacientes[12,13]. Una vez alcanzado, se puede mantener el tratamiento, reducir progresivamente las dosis a 50 mg cada 3 o 4 semanas o bien suspenderlo e introducirlo nuevamente en caso de rebrote[14]. Etanercept también está indicado en niños[15] con psoriasis moderada-grave a una dosis de 0,8 mg/Kg (hasta un máximo de 50 mg). También se puede indicar en pacientes embarazadas. La patente de etanercept también ha caducado y se ha comercializado un biosimilar de este fármaco, Benepali®, de efectividad igualmente equiparable[16].
c. ADALIMUMAB (Humira®)
Se administra igualmente por vía subcutánea. El tratamiento suele iniciarse con una dosis de inducción de 80 mg (2 inyecciones) en la semana 0 y 40 mg (1 inyección) en la semana 1 y luego se administra cada 2 semanas como mantenimiento[17,18]. Se ha comprobado que con adalimumab consiguen el PASI-75 entre el 68 y el 87% de los pacientes[19,20]. Se ha comprobado que adalimumab es más efectivo que metotrexato (estudio CHAMPION)[21]. La patente de adalimumab (Humira®) caducará el año próximo en Europa y ya se están ensayando biosimilares (ABP 501)[22].
Efectos adversos de los fármacos biológicos anti-TNF
Suelen ser fármacos bien tolerados y sus efectos secundarios son leves y similares a los del placebo, aunque entre el 5 y el 20% de los pacientes tienen que suspender el tratamiento por efectos adversos (EA). No se ha demostrado que sean hepatotóxicos ni nefrotóxicos y pueden administrarse en situaciones de insuficiencia renal o hepática[23].
Con el infliximab los EA más frecuentes son las reacciones agudas a la infusión. Se producen hasta en un 20% de los casos. Son por lo general leves y consisten en escalofríos, mareo, cefalea, sofoco o nausea. Para evitarlas se debe administrar el fármaco lentamente durante unas 2 horas y mantenerle en observación 1 hora más. Ocasionalmente se han producido reacciones graves de tipo anafilactoide como urticaria o disnea, que precisan tratamiento con adrenalina por su efecto inmediato[24]. Aparecen con mayor frecuencia entre los pacientes que desarrollan anticuerpos anti-infliximab[25], lo que sucede entre el 35 y el 50% de los pacientes, algo que se ha correlacionado con una reducción en la respuesta clínica.

Autor/a: geralt
Fuente: Pixabay / Public Domain
Ahora bien, los EA más comunes de todos los anti-TNF-α, son las reacciones cutáneas en el punto de inyección[11]. Generalmente, son autolimitadas y no requieren tratamiento. Consisten en eritema, prurito, hemorragia, dolor e inflamación. Se producen en un 10-20% de los casos y suelen aparecer durante el primer mes de tratamiento. Ocasionalmente puede ser necesario aplicar un corticoide tópico o administrar un antihistamínico. Muy raramente motivan la interrupción del tratamiento. También pueden causar otros efectos secundarios leves como cefalea, astenia, artromialgias, cuadro pseudogripal y náuseas y provocar una diversidad de manifestaciones cutáneas. Se ha producido en algunos casos un efecto paradójico consistente en la aparición de psoriasis de novo, o el empeoramiento de una psoriasis preexistente. Este efecto paradójico suele aparecer al cabo de 9.5 meses de media del inicio del tratamiento[26,27].
Por su capacidad inmunosupresora, los fármacos anti-TNF-α pueden favorecer la aparición de infecciones. Suelen ser leves y afectar la piel, en forma de foliculitis o abscesos, o las vías aéreas superiores, dando lugar a sinusitis o faringoamigdalitis[28]. También se han descrito casos de infecciones graves como neumonías o pielonefritis[29,30] que pueden comprometer la vida del paciente. Por otra parte, el TNF-α es una citocina proinflamatoria que interviene en la defensa del huésped frente a bacterias patógenas, especialmente frente a las intracitoplasmáticas[31]. Por ello se han descrito numerosos casos de infecciones granulomatosas intracelulares bacterianas (meningoencefalitis por Legionella pneumophila [32], nocardiosis, Mycobacterium fortuitum[33], leishmaniasis visceral[34] y se han descrito más de 300 casos de micosis profundas (80% causadas por infliximab). De todos modos, uno de los riesgos más preocupantes de los fármacos anti-TNF-α es la reactivación de una tuberculosis latente, que al inicio del uso de biológicos fue la responsable del 50% de las muertes por infección[35,36]. En nuestro medio, dado que el riesgo de tuberculosis es alto, se recomienda extremar las medidas de prevención. Debe realizarse una historia completa, incluyendo antecedentes personales y familiares de la enfermedad y posibles contactos, radiografía de tórax y prueba de la tuberculina o el cuantiferón. Si alguna de estas pruebas es positiva, se debe descartar una tuberculosis activa y en este caso realizar un tratamiento tuberculostático triple. Si se trata de una tuberculosis latente, se recomienda tratamiento profiláctico con isoniazida durante 6-9 meses[37]. En estos casos el tratamiento con fármacos biológicos deberá diferirse unas 4 semanas. Existen algunas dudas sobre la seguridad del tratamiento con fármacos anti-TNF-α en pacientes portadores del virus de la hepatitis C (VHC) o de la hepatitis B (VHB). En caso de detectar una serología positiva para alguno de estos virus, recomendamos realizar una consulta con el hepatólogo, especialmente en los casos de hepatitis B, ya que una reactivación del virus puede ser fatal[2]. El etanercept parece ser seguro en caso de hepatits C, incluso en algunas ocasiones los enfermos han mejorado y siempre se puede ofrecer tratamiento específico con rivabirina, ya sea con o sin interferón-α y ribavirina[38,39]. Etanercept también puede administrarse en caso de infección por el VIH, ya que no parece aumentar el riesgo de infecciones oportunistas[40,41].

Autor/a: webvilla
Fuente: Pixabay / Public Domain
Ahora bien, la principal preocupación se refiere al riesgo de provocar neoplasias, en especial linfomas. Se ha visto que el tratamiento a largo plazo de muchas enfermedades inflamatorias autoinmunes con fármacos anti-TNF-α se asocia a un incremento en el riesgo de linfoma Hodgkin, pero sobre todo de tipo no Hodgkin[42]. En un estudio prospectivo sobre 18,572 pacientes con artritis reumatoide incluidos en el National Data Bank for Rheumatic Diseases, la tasa de incidencia estandarizada (SIR) de linfoma en conjunto fue de 1.9; con el uso de biológicos aumentaba a 2.9 (con infliximab 2.6 y con etanercept 3.8), mientras que para aquellos pacientes que no recibían biológicos fue de 1.0[43]. Un mayor número de casos estaban relacionados con el tratamiento de la enfermedad de Crohn (EC) con fármacos anti-TNF (p < 0.0001) (especialmente el linfoma hepatosplénico, una forma rara de linfoma T periférico γδ, agresivo y generalmente mortal, observado en varones jóvenes). También se observó que algunos de estos linfomas están relacionados con el virus de Epstein-Barr[44], como sucede con los linfomas de pacientes trasplantados o bajo tratamiento inmunosupresor.
Los fármacos anti-TNF-α también pueden producir complicaciones neurológicas. En un estudio sobre pacientes tratados de diversas enfermedades reumáticas, psoriasis y enfermedad de Crohn, se detectaron 5 casos de desmielinización central o periférica, 1 de lupus eritematoso sistémico del sistema nervioso central con síndrome antifosfolípido, 1 caso de encefalitis por virus Epstein-Barr, 1 de polineuropatía sensitiva axonal y otro con polineuropatía de fibra pequeña[45]. Cerca del 50% de los pacientes mejoraron al suspender el anti-TNF. También se han descrito algunos casos de neuropatía periférica[46] en pacientes en tratamiento con infliximab que mejoraron al suprimir la medicación. Por ello, los fármacos anti-TNF están contraindicados en pacientes con alguna de estas patologías y se desaconsejan en pacientes con familiares de primer grado con enfermedad desmielinizante.
Abandono del tratamiento anti-TNF-α
Los motivos suelen ser la aparición de cualquiera de los efectos secundarios referidos anteriormente o bien la pérdida de eficacia. Como hemos comentado, esto ocurre en un 10-30% de los pacientes al cabo de unos 4 años. Es debido al desarrollo de anticuerpos contra el propio anti-TNF, lo que bloquea el fármaco[47]. Esto se evitaría añadiendo metotrexate. Si aun así el paciente no mejora, podemos ensayar un tratamiento combinado con dipropionato de betametasona o con calcipotriol tópicos, o bien con acitretina oral, o con fototerapia UVB de banda estrecha (UVB-BE) 3 días a la semana[48].
2. ANTICUERPOS ANTI-IL-12/23: USTEKINUMAB (Stelara®)

Autor/a: Dafne Cholet
Fuente: Flickr / Creative Commons
Su dosificación es la más cómoda entre los biológicos, puesto que se administra cada 3 meses en inyección subcutánea[49]. Se utiliza a una dosis de 45 mg, en pacientes cuyo peso sea menor de 100 kg, y de 90 mg en aquellos en los que su peso sobrepase los 100 kg, en las semanas 0 y 4 y después cada 12 semanas[50]. Aproximadamente 2/3 partes de los pacientes obtienen el PASI-75 a las 12 semanas de tratamiento[51]. El efecto se inicia rápidamente, dado que el 60% de los pacientes alcanzan un PGA de ‘blanqueado’ o ‘casi blanqueado’ en la semana 12[52]. Debido a la comodidad de su posología, los pacientes tratados con ustekinumab mostraron una adherencia superior al tratamiento en comparación con adalimumab y etanercept[53]. De igual modo, es efectivo en pacientes que han desarrollado un efecto paradójico (inducción o exacerbación de una psoriasis) con los anti-TNF-α.
De manera simultánea a la mejora del PASI, el ustekinumab también mejora la calidad de vida. El DLQI promedio de los pacientes fue > 10, indicando un impacto significativo de la psoriasis sobre la calidad de vida. En la semana 12 de tratamiento, una proporción significativamente mayor de los pacientes que habían recibido ustekinumab 45 y 90 mg alcanzaron un DLQI normal (≤1), en comparación con placebo (p <0.001) Las mejoras más ostensibles fueron las referidas al dolor corporal y la del funcionamiento social[54]. También se vio que mejoraba la función sexual en más de un 20% de los pacientes, y que en la semana 12 había mejorado un -9.13 (vs. -0.53 con placebo; p<0.001). Esta mejora en las dificultades sexuales se correlacionó con la reducción del PASI[55].
Efectos adversos del Ustekinumab
En la mayoría de estudios realizados, el ustekinumab ha sido bien tolerado y sus efectos adversos (EA) comparables a los del placebo. En el estudio PHOENIX-1, durante la fase controlada con placebo, se produjeron EA en 278/510 (54.5%) de los pacientes que recibieron ustekinumab y en 123/255 (48.2%) de los que recibieron placebo. Se produjeron EA graves en 6 (1.2%) de los que recibieron ustekinumab y en 2 (0.8%) de los que recibieron placebo. Lo mismo sucedió en la fase final del estudio[51]. Entre los efectos adversos comunes destacaban las infecciones del tracto respiratorio superior, cefalea, artralgias y tos y las reacciones en el lugar de la inyección[50]. Un 5% de los pacientes desarrolló anticuerpos anti-ustekinumab[56]. A los 3 años de seguimiento, la tasa de EA por 100 pacientes-año con ustekimumab 45 mg fue de 305.2/100 pacientes/año y con 90 mg de 305.9/100 pacientes/año, mientras que la tasa de EA graves con 45 mg fue de 6.8/100 pacientes/año y con 90 mg de 8.2/100 pacientes/año. No se detectaron casos de desmielinización, ni un aumento del número total de infecciones ni de tuberculosis. Por otra parte, el número total de infecciones y de infecciones graves por 100 pacientes/año fue similar entre los pacientes de los grupos placebo (121.0 y 1.70), ustekinumab 45 mg (145.7 y 0.49) y ustekinumab 90 mg (132.2 y 1.97) respectivamente. La tasa se mantuvo estable durante los 3 años de seguimiento posteriores. Las tasas de neoplasias durante los períodos controlados con placebo también fueron similares entre los grupos (placebo: 1.70; 45 mg: 0.99; 90 mg: 0.98) y permanecieron estables a lo largo del tiempo en los grupos tratados con ustekinumab. La tasa de neoplasias fue comparable a la esperada en la población general[57]. En un trabajo del grupo español del Biobadaderm se estudiaron las infecciones graves registradas en la base de datos[58], detectando que estaban incrementadas en el grupo de pacientes que habían recibido infliximab (riesgo relativo, RR = 1.71), adalimumab combinado con metotrexate (RR = 2.13), ciclosporina (RR = 3.12) y ustekinumab con metotrexate (RR 0 1.56). En otro estudio de Papp sobre la base de datos PSOLAR se evidenció que ustekinumab era el biológico que causaba infecciones con menor frecuencia [59].

Autor/a: mararie
Fuente: Flickr / Creative Commons
En cuanto a la tasa de eventos cardiovasculares mayores (ECVM), se realizó un meta-análisis sobre los 22 estudios randomizados y controlados contenidos en el Cochrane Central Register of Controlled Trials, el ClinicalTrials.gov y el Ovid MEDLINE, que incluían un total de 10.183 pacientes. Se evaluaron las diferencias absolutas de riesgo entre el fármaco y el placebo. Entre los 3.179 pacientes que recibieron terapia anti-IL-12/23, 10 experimentaron un ECVM comparado con 0 entre 1474 pacientes de los que recibieron placebo. En los ensayos con terapia anti-TNF-α, solo 1 de 3858 pacientes presentaron un ECVM respecto a 1 de 1812 de los que recibieron placebo, sin diferencias significativas entre los 3 grupos[60].
El ustekinumab también puede producir un efecto paradójico y hacer brotar una psoriasis de novo o bien empeorar una psoriasis ya existente[61].
3. ANTICUERPOS ANTI-IL-17
La IL-17 se considera uno de los mediadores más importantes de la inflamación en la psoriasis y la artritis psoriásica. Es expresada principalmente por las células Th17 en la zona de inflamación. Ahora bien, casi todas las células inflamatorias presentes en dicha zona tienen receptor para IL-17A y responden a la misma con la liberación de citocinas y quimiocinas diseñadas para activar los neutrófilos y las células T memoria. Todo ello mantiene un estado pro-inflamatorio que caracteriza a las enfermedades autoinflamatorias/autoinmunes como la psoriasis, la artritis psoriásica, la artritis reumatoide, la espondilitis anquilosante y otras enfermedades similares[62].
a. SECUKINUMAB (COSENTYX®)
La IL-17 es una interleucina muy importante en la defensa de las infecciones y en la autoinmunidad. Es sintetizada por los linfocitos Th17, aunque también la producen las células γδ, las células Th17 innatas, las natural killer, los macrófagos y las células de Paneth[63]. La IL-17A está incrementada en la psoriasis[64], en la que juega un papel fundamental. El secukinumab es un monoclonal anti-IL17 y se ha visto que es muy efectivo en la psoriasis crónica en placas, la artritis reumatoide y la artritis psoriásica. Se emplea por vía subcutánea en plumas precargadas de 150 mg. La dosis inicial son 300 mg (2 inyectables de 150 mg) semanales las semanas 0 a 4, seguido de una dosis mensual (cada 4 semanas) de mantenimiento de 300 mg[65]. En los ensayos se ha comprobado que con estas dosis alrededor del 80% de los pacientes alcanzan el PASI75 y más del 60% el PASI90[66,67], la mayoría antes de las 4 semanas.
Efectos adversos del Secukinumab
Durante los estudios pivotales la tasa de EA ha sido similar a la del placebo, siendo el más frecuente los catarros de vías aéreas superiores y la cefalea. También se han descrito pacientes con reacciones en el lugar de inyección, infecciones, en particular cándida leves-moderadas (4.7%), e infestaciones[66]. No se detectaron muertes ni EA graves. El secukinumab también puede producir neutropenia[68], ya que la IL-17A estimula la granulopoyesis y el tráfico de neutrófilos[69], y puede exacerbar o desencadenar de novo una enfermedad de Crohn y dar reacciones alérgicas del tipo de la urticaria, por lo general leve o moderada, en algunos casos asociada a angioedema[70].

Fuente: www.farmacosalud.com / Imagen de ARCHIVO
Gentileza del Centro Nacional de Microbiología. Instituto de Salud Carlos III de Madrid
B) IXEKIZUMAB (TALTZ®)
Es el fármaco biológico de más reciente comercialización. Según los resultados de los ensayos pivotales UNCOVER-1, UNCOVER-2 y UNCOVER-3, se administra por vía subcutánea una dosis de inducción de 160 mg y posteriormente se administran 80 mg cada 4 semanas (IXEC4S). Con estas dosis alcanzaron el PASI75 cerca del 90% de los pacientes en 12 semanas[71]. Posteriormente se comprobó, en la fase de extensión del tratamiento hasta la semana 60, que cerca del 80% mantenían el PASI75[72], por lo que se puede decir que la eficacia del fármaco es la mayor de todos los fármacos probados hasta la fecha en la psoriasis[73,74]. Se ha comprobado también que es igualmente efectivo en localizaciones de difícil tratamiento como las manos, en las que se obtuvo una mejora del 75% por el 70% de los pacientes, y de un 100% en el 50%[75], o en el cuero cabelludo, con unas mejorías de más del 70% a las 12 semanas[76], que ya se hicieron evidentes en el primer mes y se mantuvieron en las 60 semanas del ensayo. El IXE es efectivo asimismo en las uñas[77]. Por otra parte, se ha comprobado que en pocas semanas se alcanza una mejora de la calidad de vida y del prurito. Se produjo una reducción del DLQI en más de 5 puntos y de la escala numérica del prurito en más de 4 al cabo de 2 semanas[78]. Asimismo, también se ha visto que con IXE mejora la productividad en el trabajo[79]. Mediante un cuestionario se detectó una mejoría significativa de 3.5 puntos y de la actividad de 24.5 puntos, tanto a corto como a largo plazo[80].
Efectos adversos del Ixekizumab
Los EA más importantes del tratamiento con IXE son la neutropenia, las infecciones por cándida y la enfermedad inflamatoria intestinal. Durante el período de inducción experimentaron 1 o más EA emergentes 251 pacientes, mientras que los EA graves fueron 8.3. Durante el mantenimiento con IXE, la tasa de EA emergentes y EA graves fue de 100.4 y 7.8, respectivamente. Durante la inducción, el IR de infección por cándida fue de 2.5 y el IRs de EA emergentes de especial interés (incluyendo infecciones graves, neoplasias y eventos cardiovasculares mayores) fueron comparables a los de etanercept[81]. En otro estudio se comprobó que el número de EA graves fue de 14 (1•9%) con IXEC4S, mientras que no se detectó ningún caso mortal[71]. En un estudio que incluyó a 78 pacientes con psoriasis en placas, 8 con psoriasis eritrodérmica y 5 con psoriasis pustulosa generalizada, se detectaron EA leves o moderados en 79/91: nasofaringitis, dermatitis seborreica, urticaria y reacciones en el lugar de la inyección[82]. Además, analizando conjuntamente los EA de los 7 ERC se detectaron 19 casos de enfermedad inflamatoria intestinal (EII) (7 casos de enfermedad de Crohn (EC), lo que representa una tasa de incidencia de 1.1/1000 pacientes-exposición año; 12 de colitis ulcerosa (CU), tasa de incidencia 1.9/1000 pacientes-exposición año). Tres de los casos se produjeron durante la inducción (1 EC, 2 CU) y 7 durante el mantenimiento (4 EC; 3 CU). Ahora bien, 12 de los pacientes que tenían historia previa de EII no tuvieron efectos secundarios graves[82]. Igualmente, se han detectado en sangre anticuerpos anti-fármaco, aunque a niveles bajos, sin interferir en la respuesta cínica[83].
Por otra parte, existe un estudio sobre el tratamiento de la artritis reumatoide con IXE en 232 pacientes naïve a biológicos y 158 pacientes resistentes a anti-TNF, encontrándose 17 EA graves que representaron un 7% entre los pacientes naïve (5 infecciones graves y 2 muertes) y 18 (11%) en los pacientes resistentes a TNF (4 infecciones graves y 1 muerte). Entre ellos no se detectaron infecciones micobacterianas ni fúngicas invasivas[84].
En conclusión, IXE es un medicamento antiinflamatorio-inmunosupresor selectivo anti-IL17A, una de las citocinas centrales en la patogénesis de la psoriasis. Con IXE se consigue el PASI75 por cerca del 90% de los pacientes a las 12 semanas con relativamente pocos EA. Ahora bien, hemos de tener en cuenta que su seguridad todavía no está garantizada más allá de las 60 semanas[72].
CONCLUSIONES

Autor/a: George Hodan
Fuente: www.publicdomainpictures.net
Los fármacos biológicos constituyen una importante mejora en el tratamiento actual de la psoriasis moderada-grave[85]. Su eficacia y seguridad está fuera de toda duda después de casi 20 años del inicio de su comercialización. A pesar de la escasez de estudios comparativos cara a cara, los más potentes y efectivos parecen ser infliximab y secukinumab e ixekizumab que proporciona el PASI75 en el 80-90% de los pacientes, niveles similares a los obtenidos por el PUVA, el re-PUVA y la ciclosporina. Secukinumab e ixekizumab llevan poco tiempo comercializados, por lo que no tenemos conocimiento de la seguridad y la eficacia a largo plazo. En un nivel intermedio se situarían adalimumab y ustekinumab, con los que alcanzan el PASI-75 el 65-75% de los pacientes al cabo de unas 12 semanas, una efectividad comparable a la del re-UVB y un peldaño por encima de la alcanzada con el etanercept, la fototerapia UVB de banda estrecha, los métodos de Ingram y de Goeckerman, el metotrexate y los retinoides, con los que se alcanza el PASI-75 en un 50-60% de los pacientes. Los principales frenos a su diseminación son el coste de los mismos y la falta de experiencia en cuanto a seguridad a largo plazo, principalmente en lo referente a infecciones graves, tuberculosis e infecciones oportunistas, y neoplasias, en particular linfomas. Con los biológicos, su potencia y eficacia es probable que vayan paralelas a su capacidad de inmunosupresión y por tanto en relación inversa con su seguridad. En la práctica su capacidad de inmunosupresión debe ser similar a la de los inmunosupresores clásicos como la ciclosporina, puesto que en un estudio se comprobó que el número de ingresos por infecciones graves era similar.
Por ello, hemos de recordar que antes de iniciar el tratamiento con inmunosupresores biológicos es preciso realizar una historia completa, incidiendo sobre antecedentes de tuberculosis, neoplasias, enfermedad desmielinizante o cardiopatía moderada o grave, y solicitar la determinación de un PPD o cuantiferón y una placa de tórax, y las serologías de hepatitis B y C y del virus de la inmunodeficiencia humana.
Bibliografía
1. JM Casanova, JM Fernández, X Gómez, M Buti, V Sanmartin, MC Sanz, L Garcia, M Ortega. Psoriasis epidemiologia, síndrome metabólico y factores de riesgo cardiovascular. 2º Congreso Nacional de Psoriasis. Madrid 2017.
2. Armstrong AW, Aldredge L, Yamauchi PS. Managing Patients With Psoriasis in the Busy Clinic: Practical Tips for Health Care Practitioners. J Cutan Med Surg. 2016;20:196-206.
3. Herrier RN. Advances in the treatment of moderate-to-severe plaque psoriasis. Am J Health Syst Pharm. 2011; 68:795-806.
4. Boehncke WH, Prinz J, Gottlieb AB. Biologic Therapies for Psoriasis. A Systematic Review. J Rheumatol 2006; 33:1447–51.
5. van Lümig PP, Driessen RJ, Roelofs-Thijssen MA, Boezeman JB, van de Kerkhof PC, de Jong EM. Relevance of laboratory investigations in monitoring patients with psoriasis on etanercept or adalimumab. Br J Dermatol. 2011; 165:375-82.
6. Bedini C, Nasorri F, Girolomoni G, Pita OD, Cavani A. Antitumour necrosis factor-alpha chimeric antibody (infliximab) inhibits activation of skin-homing CD4+ and CD8+ T lymphocytes and impairs dendritic cell function. Br J Dermatol 2007; 157:249–58.
7. Casanova JM, Sanmartin V, Baradad M, Ferran M, Pujol RM, Ribera M. Tratamiento de la psoriasis en placas moderada y grave con infliximab. Piel: formación continuada en dermatologia. 2008;23:523-528.
8. Dapavo P, Vujic I, Fierro MT, Quaglino P, Sanlorenzo M. The infliximab biosimilar in the treatment of moderate to severe plaque psoriasis. J Am Acad Dermatol. 2016; 75:736-9.
9. Jha A, Upton A, Dunlop WC, Akehurst R. The Budget Impact of Biosimilar Infliximab (Remsima®) for the Treatment of Autoimmune Diseases in Five European Countries. Adv Ther. 2015; 32:742-56.
10. Casanova JM, Sanmartin V, Martí RM, Ferran M, Pujol RM, Ribera M. Tratamiento de la psoriasis en placas moderada y grave con etanercept. Piel: formación continuada en dermatologia. 2009;24:105-113.
11. Pariser DM, Leonardi CL, Gordon K, Gottlieb AB, Tyring S, Papp KA, Li J, Baumgartner SW. Integrated safety analysis: Short- and long-term safety profiles of etanercept in patients with psoriasis. J Am Acad Dermatol. 2012;67:245-56.
12. Papp KA, Tyring S, Lahfa M, Prinz J, Griffiths CE, Nakanishi AM, et al. A global phase III randomized controlled trial of etanercept in psoriasis: safety, efficacy, and effect of dose reduction. Br J Dermatol 2005; 152:1304-12.
13. Gordon KB, Gottlieb AB, Leonardi CL, Elewski BE, Wang A, Jahreis A, Zitnik R. Clinical response in psoriasis patients discontinued from and then reinitiated on etanercept therapy. J Dermatolog Treat 2006; 17:9-17.
14. Ahmad K, Rogers S. Two years of experience with etanercept in recalcitrant psoriasis. Br J Dermatol 2007; 156:1010–4.
15. Paller AS, Siegfried EC, Langley RG, Gottlieb AB, Pariser D, Landells I, et al. Etanercept treatment for children and adolescents with plaque psoriasis. N Engl J Med 2008; 358:241-51.
16. Griffiths CE, Thaçi D, Gerdes S, Arenberger P, Pulka G, Kingo K, Weglowska J; EGALITY study group, Hattebuhr N, Poetzl J, Woehling H, Wuerth G, Afonso M. The EGALITY study: a confirmatory, randomized, double-blind study comparing the efficacy, safety and immunogenicity of GP2015, a proposed etanercept biosimilar, vs. the originator product in patients with moderate-to-severe chronic plaque-type psoriasis. Br J Dermatol. 2016 Oct 27. doi: 10.1111/bjd.15152
17. Gordon KB, Langley RG, Leonardi C, Toth D, Menter MA, Kang S, et al. Clinical response to adalimumab treatment in patients with moderate to severe psoriasis: double-blind, randomized controlled trial and open-label extension study. J Am Acad Dermatol 2006;55:598-606.
18. Casanova JM, Sanmartin V, Baradad M, Ferran M, Pujol RM, Ribera M. Tratamiento de la psoriasis en placas moderada y grave con adalimumab. Piel: formación continuada en dermatologia. 2008;23:581-585.
19. Papoutsaki M, Chimenti MS, Costanzo A, Talamonti M, Zangrilli A, Giunta A, et al. Adalimumab for severe psoriasis and psoriatic arthritis: an open-label study in 30 patients previously treated with other biologics. J Am Acad Dermatol 2007;57:269-75.
20. Fotiadou C, Lazaridou E, Sotiriou E, Ioannides D. Adalimumab for psoriasis in Greece: clinical experience in a tertiary referral centre. J Eur Acad Dermatol Venereol. 2012;26:1298-303.
21. Saurat JH, Stingl G, Dubertret L, Papp K, Langley RG, Ortonne JP, et al. Efficacy and safety results from the randomized controlled comparative study of adalimumab vs. methotrexate vs. placebo in patients with psoriasis (CHAMPION). Br J Dermatol 2008; 158:558–66.
22. Papp K, Bachelez H, Costanzo A, Foley P, Gooderham M, Kaur P, Narbutt J, Philipp S, Spelman L, Weglowska J, Zhang N, Strober B. Clinical similarity of biosimilar ABP 501 to adalimumab in the treatment of patients with moderate to severe plaque psoriasis: A randomized, double-blind, multicenter, phase III study. J Am Acad Dermatol. 2017. pii: S0190-9622(16)31238-5.
23. Hoover WD. Etanercept therapy for severe plaque psoriasis in a patient who underwent a liver transplant. Cutis 2007; 80:211-4.
24. Chávez-López MA, Delgado-Villafañé J, Gallaga A, Huerta-Yáñez G. Severe anaphylactic reaction during the second infusion of infliximab in a patient with psoriatic arthritis. Allergol Immunopathol (Madr) 2005;33:291-2.
25. Gottlieb AB, Evans R, Li S, Dooley LT, Guzzo CA, Baker D, Bala M, Marano CW, Menter A. Infliximab induction therapy for patients with severe plaque-type psoriasis: a randomised, double-blind, placebo-controlled trial. J Am Acad Dermatol 2004; 51:534–42.
26. Wollina U, Hansel G, Koch A, Schönlebe J, Köstler E, Haroske G. Tumor necrosis factor-alpha inhibitor-induced psoriasis or psoriasiform exanthemata: first 120 cases from the literature including a series of six new patients. Am J Clin Dermatol 2008; 9:1-14.
27. Shmidt E, Wetter DA, Ferguson SB, Pittelkow MR. Psoriasis and palmoplantar pustulosis associated with tumor necrosis factor-α inhibitors: The Mayo Clinic experience, 1998 to 2010. J Am Acad Dermatol. 2012; 67:e179-85.
28. Gottlieb AB, Leonardi CL, Goffe BS, Ortonne JP, van der Kerkhof PC, Zitnik R, et al. Etanercept monotherapy in patients with psoriasis: a summary of safety, based on an integrated multistudy database. J Am Acad Dermatol 2006; 54(Suppl):S92-100.
29. Wallis RS, Broder MS, Wong JY, Hanson ME, Beenhouwer DO. Granulomatous infectious diseases associated with tumor necrosis factor antagonists. Clin Infect Dis 2004; 38:1261-5.
30. Scheinfeld N. Adalimumab: a review of side effects. Expert Opin Drug Saf 2005; 4:637-41.
31. Ahmad K, Rogers S. Two years of experience with etanercept in recalcitrant psoriasis. Br J Dermatol 2007; 156:1010–4.
32. Fabroni C, Gori A, Prignano F, Lotti T. A severe complication of anti-TNF alfa treatment. G Ital Dermatol Venereol 2010; 145:775-7.
33. Chang MB, Sri JC, Driscoll M, Gaspari AA. Mycobacterium fortuitum infection following adalimumab treatment for psoriasis and subsequent complication-free treatment with alternate TNF-a blockers. J Drugs Dermatol. 2011;10:914-6.
34. Tektonidou MG, Skopouli FN. Visceral leishmaniasis in a patient with psoriatic arthritis treated with infliximab: reactivation of a latent infection?. Clin Rheumatol 2007; 27:541-2
35. Keane J, Gershon S, Wise RP, Mirabile-Levens E, Kasznica J, Schwieterman WD, Siegel JN, Braun MM. Tuberculosis associated with infliximab, a tumor necrosis factor alpha-neutralizing agent. N Engl J Med 2001; 345:1098-104.
36. Lim WS, Powell RJ, Johnston ID. Tuberculosis and treatment with infliximab. N Engl J Med 2002;346:623-6.
37. Theis VS, Rhodes JM. Review article: minimising Tuberculosis during anti-TNF-alpha treatment of inflammatory bowel disease. Aliment Pharmacol Ther 2008;27:19-30.
38. Brunasso AM, Puntoni M, Gulia A, Massone C. Safety of anti-tumour necrosis factor agents in patients with chronic hepatitis C infection: a systematic review. Rheumatology (Oxford) 2011; 50:1700-11.
39. Sagnelli E, Pisaturo M, Martini S, Sagnelli C, Filippini P, Coppola N. Advances in the treatment of hepatitis B virus/hepatitis C virus coinfection. Expert Opin Pharmacother. 2014; 15:1337-49.
40. Cepeda EJ, Williams FM, Ishimori ML, Weisman MH, Reveille JD. The use of anti-tumour necrosis factor therapy in HIV-positive individuals with rheumatic disease. Ann Rheum Dis 2008; 67:710-2.
41. Kaur PP, Chan VC, Berney SN. Successful etanercept use in an HIV-positive patient with rheumatoid arthritis. J Clin Rheumatol 2007;13:79-80.
42. Yildirim-Toruner C, Kimura Y, Rabinovich E. Hodgkin's lymphoma and tumor necrosis factor inhibitors in juvenile idiopathic arthritis. J Rheumatol. 2008;35:1680-1.
43. Wolfe F, Michaud K. Lymphoma in rheumatoid arthritis: the effect of methotrexate and anti-tumor necrosis factor therapy in 18,572 patients. Arthritis Rheum. 2004;50:1740-51.
44. Mariette X, Tubach F, Bagheri H, Bardet M, Berthelot JM, Gaudin P, Heresbach D, Martin A, Schaeverbeke T, Salmon D, Lemann M, Hermine O, Raphael M, Ravaud P. Lymphoma in patients treated with anti-TNF: results of the 3-year prospective French RATIO registry. Ann Rheum Dis. 2010;69:400-8.
45. Nozaki K, Silver RM, Stickler DE, Abou-Fayssal NG, Giglio P, Kamen DL, Daniel R, Judson MA. Neurological Deficits During Treatment With Tumor Necrosis Factor-Alpha Antagonists. Am J Med Sci. 2011;342:352-5.
46. Tektonidou MG. Neurological complications of infliximab. J Rheumatol 2007;34:237.
47. Gniadecki R, Kragballe K, Dam TN, Skov L. Comparison of drug survival rates for adalimumab, etanercept and infliximab in patients with psoriasis vulgaris. Br J Dermatol. 2011;164:1091-96.
48. Lynde CW, Gupta AK, Guenther L, Poulin Y, Levesque A, Bissonnette R. A randomized study comparing the combination of nbUVB and etanercept to etanercept monotherapy in patients with psoriasis who do not exhibit an excellent response after 12 weeks of etanercept. J Dermatolog Treat. 2012;23:261-7.
49. Yeilding N, Szapary P, Brodmerkel C, Benson J, Plotnick M, Zhou H, Goyal K, Schenkel B, Giles-Komar J, Mascelli MA, Guzzo C. Development of the IL-12/23 antagonist ustekinumab in psoriasis: past, present, and future perspectives. Ann N Y Acad Sci. 2011;1222:30-9.
50. Scanlon JV, Exter BP, Steinberg M, Jarvis CI. Ustekinumab: treatment of adult moderate-to-severe chronic plaque psoriasis. Ann Pharmacother 2009;43:1456-65.
51. Leonardi CL, Kimball AB, Papp KA, Yeilding N, Guzzo C, Wang Y, Li S, Dooley LT, Gordon KB; PHOENIX 1 study investigators. Efficacy and safety of ustekinumab, a human interleukin-12/23 monoclonal antibody, in patients with psoriasis: 76-week results from a randomised, double-blind, placebo-controlled trial (PHOENIX 1). Lancet 2008; 371:1665-74.
52. Krulig E, Gordon KB. Ustekinumab: an evidence-based review of its effectiveness in the treatment of psoriasis. Core Evid. 2010;5:11-22.
53. Garcia-Valladares I, Cuchacovich R, Espinoza LR. Comparative assessment of biologics in treatment of psoriasis: drug design and clinical effectiveness of ustekinumab. Drug Des Devel Ther. 2011;5:41-9.
54. Lebwohl M, Yeilding N, Szapary P, Wang Y, Li S, Zhu Y, Reich K, Langley RG, Papp KA. Impact of weight on the efficacy and safety of ustekinumab in patients with moderate to severe psoriasis: rationale for dosing recommendations. J Am Acad Dermatol 2010; 63:571-9.
55. Guenther L, Han C, Szapary P, Schenkel B, Poulin Y, Bourcier M, Ortonne JP, Sofen HL. Impact of ustekinumab on health-related quality of life and sexual difficulties associated with psoriasis: results from two phase III clinical trials. J Eur Acad Dermatol Venereol. 2011; 25:851-7.
56. Kurzeja M, Rudnicka L, Olszewska M. New interleukin-23 pathway inhibitors in dermatology: ustekinumab, briakinumab, and secukinumab. Am J Clin Dermatol. 2011;12:113-25.
57. Gordon KB, Papp KA, Langley RG, Ho V, Kimball AB, Guzzo C, Yeilding N, Szapary PO, Fakharzadeh S, Li S, Hsu MC, Reich K. Long-term safety experience of ustekinumab in patients with moderate to severe psoriasis (Part II of II): Results from analyses of infections and malignancy from pooled phase II and III clinical trials. J Am Acad Dermatol. 2012;66:742-51.
58. Dávila-Seijo P, Dauden E, Descalzo MA, Carretero G, Carrascosa JM, Vanaclocha F, Gómez-García FJ, De la Cueva-Dobao P, Herrera-Ceballos E, Belinchón I, López-Estebaranz JL, Alsina M, Sánchez-Carazo JL, Ferrán M, Torrado R, Ferrandiz C, Rivera R, Llamas M, Jiménez-Puya R, García-Doval I. BIOBADADERM Study Group. Infections in Moderate to Severe Psoriasis Patients Treated with Biological Drugs Compared to Classic Systemic Drugs: Findings from the BIOBADADERM Registry. J Invest Dermatol. 2017; 137:313-321.
59. Papp K, Gottlieb AB, Naldi L, Pariser D, Ho V, Goyal K, Fakharzadeh S, Chevrier M, Calabro S, Langholff W, Krueger G. Safety Surveillance for Ustekinumab and Other Psoriasis Treatments From the Psoriasis Longitudinal Assessment and Registry (PSOLAR). J Drugs Dermatol. 2015;14:706-14.
60. Ryan C, Leonardi CL, Krueger JG, Kimball AB, Strober BE, Gordon KB, Langley RG, de Lemos JA, Daoud Y, Blankenship D, Kazi S, Kaplan DH, Friedewald VE, Menter A. Association between biologic therapies for chronic plaque psoriasis and cardiovascular events: a meta-analysis of randomized controlled trials. JAMA. 2011;306:864-71.
61. Kerdel FA, Valeron-Almazán P, Vitiello M, Abuchar A. Exacerbation and change of psoriasis morphology in a patient treated with ustekinumab. J Cutan Med Surg. 2011; 15:183-4.
62. Liu L, Lu J, Allan BW, Tang Y, Tetreault J, Chow CK, Barmettler B, Nelson J, Bina H, Huang L, Wroblewski VJ, Kikly K. Generation and characterization of ixekizumab, a humanized monoclonal antibody that neutralizes interleukin-17A. J Inflamm Res. 2016; 9:39-50.
63. Ouellette AJ. Paneth cells and innate mucosal immunity. Curr Opin Gastroenterol. 2010;26:547–553.
64. Harper EG, Guo C, Rizzo H, Lillis JV, Kurtz SE, Skorcheva I, Purdy D, Fitch E, Iordanov M, Blauvelt A. Th17 cytokines stimulate CCL20 expression in keratinocytes in vitro and in vivo: implications for psoriasis pathogenesis. J Invest Dermatol. 2009;129:2175–2183
65. Rich P, Sigurgeirsson B, Thaci D, Ortonne JP, Paul C, Schopf RE, Morita A, Roseau K, Harfst E, Guettner A, Machacek M, Papavassilis C. Secukinumab induction and maintenance therapy in moderate-to-severe plaque psoriasis: a randomized, double-blind, placebo-controlled, phase II regimen-finding study. Br J Dermatol. 2013;168:402–411.
66. Langley RG, Elewski BE, Lebwohl M, Reich K, Griffiths CE, Papp K, Puig L, Nakagawa H, Spelman L, Sigurgeirsson B, Rivas E, Tsai TF, Wasel N, Tyring S, Salko T, Hampele I, Notter M, Karpov A, Helou S, Papavassilis C; ERASURE Study Group; FIXTURE Study Group. Secukinumab in plaque psoriasis – results of two phase 3 trials. N Engl J Med. 2014;371:326–338.
67. Ohtsuki M, Morita A, Abe M, Takahashi H, Seko N, Karpov A, Shima T, Papavassilis C, Nakagawa H; ERASURE Study Japanese subgroup. Secukinumab efficacy and safety in Japanese patients with moderate-to-severe plaque psoriasis: subanalysis from ERASURE, a randomized, placebo-controlled, phase 3 study. J Dermatol. 2014;41:1039–1046.
68. McInnes IB, Sieper J, Braun J, Kavanaugh A, Ritchlin CT, Rahman P, van der Heijde D, Landewé R, Conaghan PG, Gottlieb AB, Richards H, Pricop L, Ligozio G, Patekar M, Mpofu S; FUTURE 2 Study Group. Efficacy and safety of secukinumab, a fully human anti-interleukin-17A monoclonal antibody, in patients with moderate-to-severe psoriatic arthritis: a 24-week, randomised, double-blind, placebo-controlled, phase II proof-of-concept trial. Ann Rheum Dis. 2014;73:349–356.
69. Ley K, Smith E, Stark MA. IL-17A-producing neutrophil-regulatory Tn lymphocytes. Immunol Res. 2006;34:229–242.
70. Blauvelt A, Prinz JC, Gottlieb AB, Kingo K, Sofen H, Ruer-Mulard M, Singh V,Pathan R, Papavassilis C, Cooper S; FEATURE Study Group. Secukinumab administration by pre-filled syringe: efficacy, safety and usability results from a randomized controlled trial in psoriasis (FEATURE). Br J Dermatol. 2015;172:484–493.
71. Griffiths CE, Reich K, Lebwohl M, van de Kerkhof P, Paul C, Menter A, Cameron GS, Erickson J, Zhang L, Secrest RJ, Ball S, Braun DK, Osuntokun OO, Heffernan MP, Nickoloff BJ, Papp K; UNCOVER-2 and UNCOVER-3 investigators. Comparison of ixekizumab with etanercept or placebo in moderate-to-severe psoriasis (UNCOVER-2 and UNCOVER-3): results from two phase 3 randomised trials. Lancet. 2015; 386(9993):541-51.
72. Gordon KB, Blauvelt A, Papp KA, Langley RG, Luger T, Ohtsuki M, Reich K, Amato D, Ball SG, Braun DK, Cameron GS, Erickson J, Konrad RJ, Muram TM, Nickoloff BJ, Osuntokun OO, Secrest RJ, Zhao F, Mallbris L, Leonardi CL; UNCOVER-1 Study Group; UNCOVER-2 Study Group; UNCOVER-3 Study Group. Phase 3 Trials of Ixekizumab in Moderate-to-Severe Plaque Psoriasis. N Engl J Med. 2016; 375:345-56.
73. Blauvelt A. Ixekizumab: a new anti-IL-17A monoclonal antibody therapy for moderate-to severe plaque psoriasis. Expert Opin Biol Ther. 2016; 16:255-63
74. Blauvelt A, Papp KA, Griffiths CE, Puig L, Weisman J, Dutronc Y, Kerr LF, Ilo D, Mallbris L, Augustin M. Efficacy and Safety of Switching to Ixekizumab in Etanercept Non-Responders: A Subanalysis from Two Phase III Randomized Clinical Trials in Moderate-to-Severe Plaque Psoriasis (UNCOVER-2 and -3). Am J Clin Dermatol. 2017. doi: 10.1007/s40257-016-0246-9.
75. Menter A, Warren RB, Langley RG, Merola JF, Kerr LN, Dennehy EB, Shrom D, Amato D, Okubo Y, Reich K. Efficacy of ixekizumab compared to etanercept and placebo in patients with moderate to severe plaque psoriasis and non-pustular palmoplantar involvement: results from three phase 3 trials (UNCOVER-1, -2, and -3). J Eur Acad Dermatol Venereol. 2017. doi: 10.1111/jdv.14237).
76. Reich K, Leonardi C, Lebwohl M, Kerdel F, Okubo Y, Romiti R, Goldblum O, Dennehy EB, Kerr L, Sofen H. Sustained response with ixekizumab treatment of moderate-to-severe psoriasis with scalp involvement: results from three phase 3 trials (UNCOVER-1, UNCOVER-2, UNCOVER-3). J Dermatolog Treat. 2016; 13:1-6.
77. Saeki H, Nakagawa H, Nakajo K, Ishii T, Morisaki Y, Aoki T, Cameron GS, Osuntokun OO; Japanese Ixekizumab Study Group. Efficacy and safety of ixekizumab treatment for Japanese patients with moderate to severe plaque psoriasis, erythrodermic psoriasis and generalized postular psoriasis: Results from a 52-week, open-label, phase 3 study (UNCOVER-J). J Dermatol. 2016. doi: 10.1111/1346-8138.13622.
78. Leonardi CL, Blauvelt A, Sofen HL, Gooderham M, Augustin M, Burge R, Zhu B, Reich K. Rapid Improvements in Health-related Quality of Life and Itch with Ixekizumab Treatment in Randomized Phase 3 Trials: Results from UNCOVER-2 and UNCOVER-3. J Eur Acad Dermatol Venereol. 2017. doi: 10.1111/jdv.14211.
79. Syed YY. Ixekizumab: A Review in Moderate to Severe Plaque Psoriasis. Am J Clin Dermatol. 2017; 18:147-158.
80. Armstrong AW, Lynde CW, McBride SR, Ståhle M, Edson-Heredia E, Zhu B, Amato D, Nikaï E, Yang FE, Gordon KB. Effect of Ixekizumab Treatment on Work Productivity for Patients With Moderate-to-Severe Plaque Psoriasis: Analysis of Results From 3 Randomized Phase 3 Clinical Trials. JAMA Dermatol. 2016; 152:661-9.
81. Strober B, Leonardi C, Papp KA, Mrowietz U, Ohtsuki M, Bissonnette R, Ferris LK, Paul C, Lebwohl M, Braun DK, Mallbris L, Wilhelm S, Xu W, Ljungberg A, Acharya N, Reich K. Short and long-term safety outcomes with ixekizumab from 7 clinical trials in psoriasis: Etanercept comparisons and integrated data. J Am Acad Dermatol. 2016. pii: S0190-9622(16)30868-4.
82. Reich K, Leonardi C, Langley RG, Warren RB, Bachelez H, Romiti R, Ohtsuki M, Xu W, Acharya N, Solotkin K, Colombel JF, Hardin DS. Inflammatory bowel disease among patients with psoriasis treated with ixekizumab: A presentation of adjudicated data from an integrated database of 7 randomized controlled and uncontrolled trials. J Am Acad Dermatol. 2017; 76:441-448.
83. Rungapiromnan W, Yiu ZZ, Warren RB, Griffiths CE, Ashcroft DM. Impact of biologic therapies on risk of major adverse cardiovascular events in patients with psoriasis: systematic review and meta-analysis of randomized controlled trials. Br J Dermatol. 2016. doi: 10.1111/bjd.14964.
84. Genovese MC, Braun DK, Erickson JS, Berclaz PY, Banerjee S,Heffernan MP, Carlier H. Safety and Efficacy of Open-label Subcutaneous Ixekizumab Treatment for 48 Weeks in a Phase II Study in Biologic-naive and TNF-IR Patients with Rheumatoid Arthritis. J Rheumatol. 2016; 43:289-97.
85. Casanova JM, Pujol RM, Ribera M. Tratamiento de la psoriasis en placas moderada y grave con fármacos biológicos. Piel: formación continuada en Dermatologia. 2008;23:479-481.




