Redacción Farmacosalud.com
La compañía AbbVie (NYSE: ABBV) ha presentado los resultados de un estudio fase 3 en pacientes con psoriasis moderada-grave que demuestran que casi la mitad de los pacientes adultos tratados con adalimumab lograron al menos una mejora de la psoriasis ungueal moderada-grave en comparación con los pacientes que recibieron placebo. La psoriasis ungueal se produce en hasta el 55% de las personas que sufren psoriasis y hasta en el 70% de las personas que sufren artritis psoriásica.[1] Se asocia a punteado, deformación, engrosamiento, decoloración y separación de la uña del lecho ungueal.[2] “La psoriasis ungueal es un trastorno muy difícil que frecuentemente no se trata debido a la falta de opciones de tratamiento”, señala Kim Papp, investigador del estudio, fundador y presidente de Probity Medical Research, Waterloo, Ontario. “Los resultados presentados son alentadores para los pacientes que viven con esta necesidad no cubierta”. En este estudio, los pacientes tratados con adalimumab cumplieron los objetivos primarios en la semana 26:3
• El 46,6% consiguieron al menos un 75% de mejora en el Índice de gravedad de la psoriasis ungueal modificado (mNAPSI) frente al 3,4% para el placebo (p<0,001)
• El 48,9% consiguieron una puntuación de psoriasis ungueal según la Evaluación global del médico de 0 (blanqueado) o 1 (leve) con al menos una mejora de 2 puntos respecto a basal frente al 6,9% para el placebo (p<0,001).
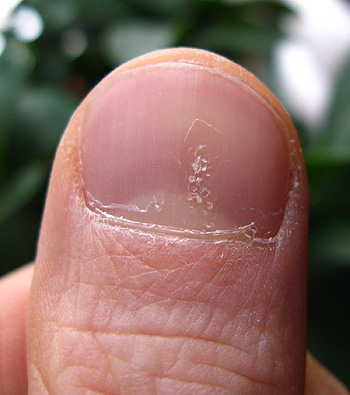
Psoriasis en la uña
Autor/a de la imagen: Seenms
Fuente: Wikimedia Commons
Este estudio fase 3[3], multicéntrico, doble ciego, aleatorizado, de grupos paralelos, controlado con placebo evaluó la seguridad y eficacia de adalimumab en pacientes con psoriasis ungueal de moderada a grave y psoriasis en placas crónica de moderada a grave. Durante las primeras 26 semanas (período A), los pacientes reclutados (n=217) fueron aleatorizados a recibir adalimumab 40 mg en semanas alternas (n=109) después de una dosis inicial de 80 mg o placebo equiparable (n=108). Después de la semana 16 en el período A, si el área de la superficie corporal afectada por la psoriasis aumentaba ≥25% respecto a basal, los pacientes podían pasar a recibir adalimumab en abierto durante 26 semanas (Período B). Los pacientes tratados con adalimumab cumplieron los objetivos primarios en la semana 26: 46,6% alcanzaron al menos una mejora del 75% en el Índice de gravedad de la psoriasis ungueal modificado (mNAPSI) frente al 3,4% para el placebo (p<0,001) y 48,9% consiguieron una puntuación de psoriasis ungueal según la Evaluación global del médico de 0 (blanqueado) o 1 (leve) con al menos una mejora de 2 puntos respecto a basal frente al 6,9% para el placebo (p<0,001).
Indicaciones terapéuticas de Adalimumab en la UE
El análisis del Período A no mostró ninguna señal de seguridad nueva con adalimumab administrado en semanas alternas hasta las 26 semanas. Se notificaron acontecimientos adversos (AA) en el 56,9% de los pacientes tratados con adalimumab y en el 55,6% de los pacientes tratados con placebo. Se notificaron acontecimientos adversos graves en el 7,3% y 4,6%, respectivamente, incluidas infecciones graves en el 3,7% de los tratados con adalimumab en comparación con el 1,9% de los tratados con placebo. La psoriasis es una enfermedad inmunitaria crónica que aparece más comúnmente en el cuero cabelludo, rodillas, hombros y zona lumbar, aunque puede aparecer en cualquier lugar de la piel[4] y también puede afectar a las uñas.[2] La psoriasis ungueal está asociada con punteado, deformación, engrosamiento, decoloración y separación de la uña del lecho ungueal.[2] La psoriasis ungueal frecuentemente pasa inadvertida y su manejo sigue siendo difícil.[2,5]
Desde que fue aprobado por primera vez hace 13 años, adalimumab ha sido aprobado en más de 90 países y actualmente se está utilizando para tratar a más de 989.000 pacientes en todo el mundo en 14 indicaciones aprobadas globalmente.[6-8] Adalimumab está aprobado en adultos para su uso en la artritis reumatoide de moderada a grave, la espondilitis anquilosante (EA) activa grave, la espondiloartritis axial grave sin signos radiográficos de EA, la psoriasis en placas crónica moderada a grave, la artritis psoriásica activa y progresiva, la enfermedad de Crohn activa de moderada a grave, la colitis ulcerosa activa de moderada a grave, la hidradenitis supurativa de moderada a grave y panuveítis no infecciosa intermedia posterior en adultos. Adalimumab está aprobado en pacientes pediátricos para su uso en la artritis asociada a entesitis, la psoriasis en placas grave, la enfermedad de Crohn activa grave y la artritis idiopática juvenil poliaraticular activa. Para conocer en detalle todas las indicaciones, consulte la ficha técnica.
Adalimumab está contraindicado en pacientes con tuberculosis activa u otras infecciones graves, como sepsis, e infecciones oportunistas y en pacientes con insuficiencia cardiaca de moderada a grave (NYHA clase III/IV). También está contraindicado en pacientes con hipersensibilidad al principio activo o a cualquiera de sus excipientes. El uso de Adalimumab aumenta el riesgo de desarrollar infecciones graves que, en casos raros, pueden ser potencialmente mortales. Se han descrito casos raros de linfoma y leucemia en pacientes tratados con adalimumab. Raramente, se ha observado un tipo grave de cáncer llamado linfoma hepatoesplénico de linfocitos T que, con frecuencia, tiene como resultado la muerte. No se puede excluir un riesgo de desarrollo de neoplasias malignas en pacientes tratados con antagonistas del TNF. Los acontecimientos adversos notificados con mayor frecuencia en todas las indicaciones fueron infecciones respiratorias, reacciones en el sitio de inyección, cefalea y dolor musculoesquelético.
Bibliografía:
1. Oram Y. Treatment of Nail Psoriasis: Common Concepts and New Trends. Dermatol Res Pract. 2013. Available at: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3666424/#B1. Accessed May 20, 2016.
2. Treating specific locations: Hands, Feet and Nails. National Psoriasis Foundation website. https://www.psoriasis.org/about-psoriasis/specific-locations/hands-feet-nails. Accessed May 20, 2016.
AbbVie Inc. +1 (847) 932-7900 1 North Waukegan Road abbvie.com North Chicago, IL 60064 GBL/HDP/0616/0745
3. Adalimumab for Nail Psoriasis: Efficacy and Safety from the First 26 Weeks of a Phase-3, Randomized, Placebo-Controlled Trial. P131. Psoriasis 2016 - 5th Congress of the Psoriasis International Network, Paris, France, 2016.
4. About Psoriasis. National Psoriasis Foundation website. https://www.psoriasis.org/about-psoriasis. Accessed May 20, 2016.
5. Rigopoulos D. (2014). Nail Psoriasis From A to Z. DOI: 10.1007/978-3-319-08810-5. Accessed May 20, 2016. Available at: http://link.springer.com/book/10.1007/978-3-319-08810-5.
6. AbbVie Data on File.
7. HUMIRA [Summary of Product Characteristics]. AbbVie Ltd.; Available at: http://ec.europa.eu/health/documents/community-register/2016/20160624135201/anx_135201_en.pdf. Last updated Jun 24, 2016. Accessed Jul 1, 2016.
8. Pharmaceutical and Medical Devices Agency (PMDA). New Drugs Approved in FY 2013. Available at: http://www.pmda.go.jp/files/000153463.pdf#page=1. Accessed May 20, 2016.




