Autor del texto: Enrique Arandes Tejero
Alprostadilo crema en el tratamiento de la disfunción eréctil.
Moderador:
Dr. Javier Romero. Responsable de la Unidad de Andrología y Funcional del Varón. Hospital Universitario 12 de Octubre. Madrid.
Ponente:
Dr. Ignacio Moncada. Jefe de Servicio de Urología. Hospital de La Zarzuela. Madrid
INTRODUCCIÓN
Aprostadilo en crema se erige como una nueva alternativa y una arma terapéutica más en el manejo de los pacientes con Disfunción eréctil. Tal y como argumentó el Dr. Ignacio Moncada, Jefe del Servicio de Urología del Hospital de La Zarzuela de Madrid, “puede ser tratamiento de primera línea para una disfunción eréctil no severa, en aquellos pacientes que aún no han recibido tratamiento”. Consigue una mejoría a corto y a largo plazo, su inicio de acción es rápido, sin preocupaciones por efectos adversos sistémicos, fácil de usar y sin interferencias con fármacos, alimentos o alcohol. Una de las claves, no obstante, para obtener una buena respuesta es el adiestramiento del paciente en cuanto a su uso, enseñando como hay que utilizarlo de forma adecuada desde las consultas. Estas son algunas de las conclusiones de la Conferencia que impartida por el Dr. Moncada y moderada por el Dr. Javier Romero, se desarrolló en el marco de la Sesión Plenaria del LXXXI Congreso Nacional de Urología (AEU) celebrada en Toledo el pasado 16 de Junio.
MECANISMO DE ACCIÓN
Alprostadilo es una molécula química que produce relajación del músculo liso cavernoso del pene y además cuenta con una sustancia denominada DDAIP.HCI, que es un potenciador de la absorción o permeación(1). Según sostiene el Dr. Moncada, el mecanismo de acción “va por otro camino distinto al de la estimulación sexual normal pero complementario al mismo tiempo”. “Podemos dar -añade el facultativo- una medicación como prostaglandina y tener estimulación sexual y tenemos las dos vías activadas”. Los inhibidores de la PDE5 actuan a través de la vía del óxido nítrico/GMP cíclico y, en cambio, Alprostadilo tanto inyectable, transuretral o con la nueva formulación tópica, actúa a través de la vía del AMP cíclico.
Un momento de la Conferencia
Autor/a de la imagen: Enric Arandes
Fuente: E. Arandes / www.farmacosalud.com
Alprostadilo, el equivalente farmacológico de la PGE1 natural, se une directamente a los receptores de PGE1 acoplados a la proteína G en la superficie de las células del músculo liso y activa la vía de cAMP, conduciendo a la relajación del músculo liso vascular del pene y a la erección del pene. Mientras los efectos de los inhibidores de PDE5 exigen la activación previa de la vía NO/guanilato ciclasa mediante estímulos erectógenos, Alprostadilo es un agonista directo que actúa de manera independiente de los componentes psicológicos y neurológicos del proceso de erección.(2,3)
La sustancia que potencia la permeacción (DDAIP.HCI) lo que hace es “separar las uniones celulares y, por tanto, permite una absorción más rápida de Alprostadilo y eso favorece que la rapidez de acción de este medicamento sea grande”.(4,5)
Alprostadilo crema tópica se aplica en gotas al meato del glande del pene y, una vez administrado, un cambio a corto plazo en la dinámica de permeación del tejido meatal permite una penetración transdérmica rápida de los principios activos del fármaco directamente en el lugar de acción necesario. “Si no se utiliza este potenciador de la absorción, la cantidad de alprostadilo que llega a los cuerpos cavernosos es mínima. Esto permite que la rapidez del fármaco sea grande”, sostiene este experto.(3)
ENSAYOS CLÍNICOS
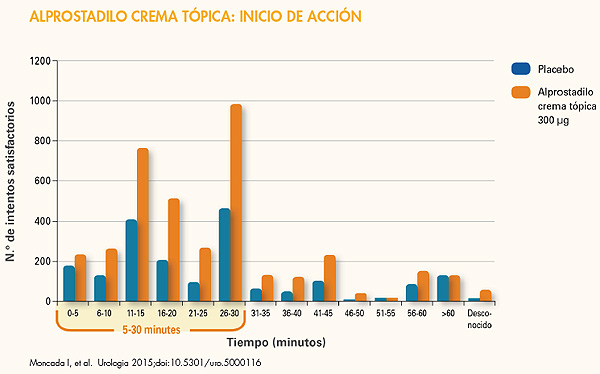
“De hecho -añade este orador- el efecto de la erección se consigue entre los 5 y los 30 minutos tras su aplicación y eso supone una ventaja para el paciente porque supone una mayor espontaneidad en la actividad sexual”. Y los estudios que se han realizado así lo confirman.
En dos estudios multicéntricos, controlados con placebo, doble ciego, de grupos paralelos, de fase III, realizados en una gran cohorte de 1.732 pacientes (media de edad, 60 años) con DE moderada a grave y problemas médicos concomitantes, se analizó la eficacia erectógena de alprostadilo crema tópica a dosis de 100, 200 ó 300 μg en comparación con placebo durante 12 semanas.
La siguiente gráfica mostraba el número de pacientes para cada intervalo de tiempo, considerando el tiempo desde la administración hasta los intentos de penetración satisfactorios para la dosis de 300 μg. Alprostadilo crema tópica a dosis de 300 μg aportó un inicio rápido de la erección (en el plazo de 5 a 30 minutos). Las erecciones duraron de una a dos horas(4).
En ensayos clínicos de fase II, que el Dr. Moncada repasó someramente en su presentación, si “miramos” el IIEF-EF o así como el domino total de función eréctil del índice Internacional de Función Eréctil vemos que hay una diferencia significativa comparada con placebo en las dosis de 300 μg. Si preguntamos al paciente globalmente la eficacia, “vemos que también hay una diferencia significativa cuando comparamos con placebo”.
En ambos estudios, los cambios en la puntuación del dominio de FE y la puntuación total del IIEF en relación con el momento basal (criterio de valoración principal y secundario, respectivamente) aumentaron significativamente en los grupos de tratamiento que recibieron la dosis más alta, y se observó una mejoría en la eficacia relacionada con la dosis en comparación con placebo.
Las puntuaciones en la pregunta del dominio de FE (capacidad para iniciar y penetrar) y la pregunta (capacidad para mantener la erección) también aumentaron significativamente con la dosis más alta en ambos estudios. “Estos resultados -sostiene el Dr. Moncada- sugieren que la formulación tópica de alprostadilo es un agente potencialmente útil para el tratamiento de la DE.(4)
En un análisis integrado de los dos ECA de búsqueda de dosis, doble ciego, multicéntricos, de fase II, sobre un total de 303 pacientes con DE, se confirmó la eficacia y la seguridad de Alprostadilo crema tópica. Los resultados obtenidos en pacientes tratados con 50, 100, 200 ó 300 μg de Alprostadilo crema tópica con potenciador de la permeación cutánea reveló que los grupos de 200 μg y 300 μg alcanzaron la mayoría de los criterios de valoración del estudio. Se observó una mejoría en la eficacia relacionada con la dosis. El criterio de valoración principal de la eficacia (cambio en la puntuación del dominio de FE en relación con el momento basal), aumentó significativamente, de una forma relacionada con la dosis, en los grupos de 100 (p=0,049), 200 (p<0,001) y 300 (p<0,001) μg, en relación con placebo. Los AA fueron de intensidad leve o moderada, limitados al lugar de aplicación y de duración corta.(7)
ANÁLISIS INTEGRADO DE ENSAYOS CLÍNICOS DE FASE II
Cambio en la puntuación del dominio de FE del IIEF desde la visita basal
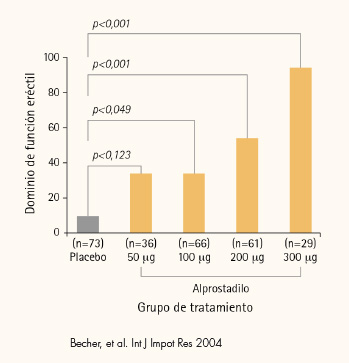 “Si miramos la curva dosis/respuesta, la eficacia de la dosis va aumentando conforme aumenta la cantidad de alprostadilo”. Según el Dr. Moncada, “eso da una idea de que es un medicamento eficaz. Si vemos que una dosis de 50 μg es menos eficaz que de 100, 200, o 300 μg, que es la que vamos a utilizar, clínicamente nos está diciendo que el efecto que tiene no es placebo sino que es un efecto que viene derivado del medicamento que estamos utilizando”.
“Si miramos la curva dosis/respuesta, la eficacia de la dosis va aumentando conforme aumenta la cantidad de alprostadilo”. Según el Dr. Moncada, “eso da una idea de que es un medicamento eficaz. Si vemos que una dosis de 50 μg es menos eficaz que de 100, 200, o 300 μg, que es la que vamos a utilizar, clínicamente nos está diciendo que el efecto que tiene no es placebo sino que es un efecto que viene derivado del medicamento que estamos utilizando”.
En los ensayos clínicos en fase III se han investigado distintas poblaciones con DE como diabéticos, con enfermedad coronaria, intervenidos de prostatectomía radical o pacientes que han fracasado con los inhibidores de la PED5 o pacientes hipertensos. “Es una eficacia en torno al 50%, no es supereficaz pero tiene una serie de ventajas”, concluyó el Dr. Moncada.
Finalmente, en un estudio abierto, a largo plazo, se observa un mantenimiento de la eficacia a largo plazo hasta 20 puntos significativamente mejor en la puntuación IIEF-EF comparada con la situación basal.
Uno de los criterios de valoración principales de eficacia fue el cambio medio en la puntuación del IIEF-EF desde el momento basal hasta la visita 5 (180 días). La mejora de la DE fue significativa en las dosis de 200 y 300 μg (p<0,0001). En la mayoría de los pacientes, la intensidad de la DE había mejorado de intensa a moderada antes del tratamiento a moderada a leve después del tratamiento.(4)
Resumiendo, según el Dr. Moncada, Alprostadilo en crema “cumple con todos los requisitos de eficacia para que pueda ser utilizado en la práctica clínica habitual”.
EFECTOS ADVERSOS
Los acontecimientos adversos de este fármaco que son más comunes, fundamentalmente, son escozor o sensación de quemazón en el pene. “Es un vasodilatador que si se aplica localmente produce este efecto”, añade el Dr. Moncada. Según este especialista, “no son efectos adversos severos, son efectos leves que se toleran bien y que no hacen suspender el tratamiento; por tanto, es muy bajo, menos del 3% de los pacientes, los que abandonan por efectos adversos”.
La seguridad se determinó a partir de los AA notificados por los pacientes y sus parejas y a partir de los cambios en los resultados de laboratorio clínico, los resultados electrocardiográficos y las constantes vitales en el ensayo de fase III. Los AA adversos estaban relacionados con el tratamiento para la dosis de 300 μg. La mayoría de los AA fueron de intensidad leve a moderada. Los AA relacionados con el tratamiento notificados con más frecuencia se produjeron localmente en el lugar de aplicación e incluyeron sensación de quemazón en el pene, dolor genital y eritema genital. La mayoría de estos AA se resolvieron en el plazo de dos horas. Menos del 7% de las parejas notificaron AA relacionados con el tratamiento, que fueron transitorios y se resolvieron en el plazo de 2 horas.(8,4)
PERFIL DE PACIENTE
Es muy importante el perfil de paciente en el que se va a utilizar. Según sostiene el Dr. Moncada, “existe la percepción de que es un medicamento no eficaz o poco eficaz y eso es porque muchas veces lo utilizamos como medicamento de segunda línea. Y en realidad las guías europeas sitúan a alprostadilo como segunda línea cuando se utiliza como inyectable o transuretral y no como tratamiento tópico”. Y concluye anunciando que en el 2017 “las nuevas guías van a situar Alprostadilo tópico como medicamento de primera línea en el tratamiento de disfunción eréctil. La diferencia entre poner un tratamiento de primera línea y segunda línea no es la eficacia del tratamiento sino la invasividad. Los tratamientos de primera línea son los tratamientos menos invasivos”, concluye el orador.

Doctor Ignacio Moncada
Autor/a de la imagen: Enric Arandes
Fuente: E. Arandes / www.farmacosalud.com
Será un tratamiento de primera línea en las siguientes situaciones, según expone el Dr. Ignacio Moncada:
-Pacientes sin tratamiento previo: pacientes naïve.
-Pacientes con DE de reciente aparición y patología leve/moderada.
-Pacientes polimedicados que cumplan los criterios anteriores o pacientes que no toleran los inhibidores de la PDE5.
-Pacientes sometidos a prostatectomía radical con buena función eréctil antes de la cirugía.
-Lesionados medulares.
Este reconocido especialista destacó especialmente el siguiente escenario con DE leve o moderada el uso de este medicamento frente al uso de IPDE5”. Por ejemplo, el “paciente que llega por primera vez a la consulta y refiere un problema de disfunción eréctil. 'Mire, doctor, que hace seis meses he empezado a notar que mis erecciones no son tan fuertes como antes'. Es en este momento cuando hemos de valorar el uso de este medicamento frente al uso de IPDE5”.
En todos estos pacientes la eficacia es alta. En pacientes prostatectomizados que no tienen defectos vasculares deben responder bien con una pequeña cantidad de alprostadilo así como los lesionados medulares sin problemas vasculares.
En una encuesta reciente, publicada en el 2015, y preguntados los pacientes con DE qué tipo de tratamiento preferirían, “ponerse una crema en el pene o tomar una pastilla”, alrededor de la mitad de los pacientes hubieran preferido utilizar de primera línea un tratamiento tópico frente a un tratamiento oral, donde siempre hay la percepción de efecto sistémico.(4)
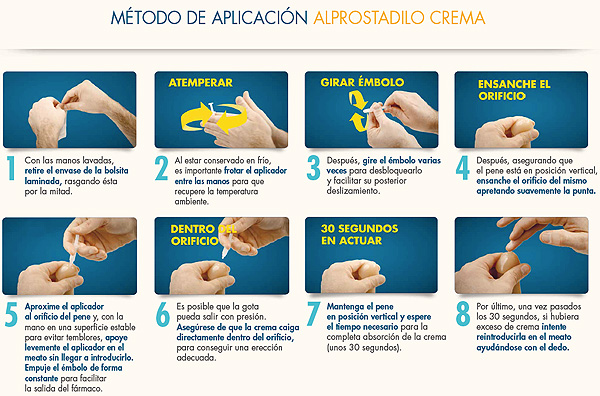
FORMA DE ADMINISTRACIÓN
El Dr. Moncada incidió especialmente en la forma de presentación de Alprostadilo tópico. Aunque parece sencillo, este especialista alertó que “muchos pacientes no lo hacen bien…La crema se cae, se pierde o no se usa adecuadamente, y da la impresión de que tiene una eficacia no muy grande”. “Es importante -añade- adiestrar al paciente y decirle 'venga usted con el medicamento y utilicémoslo en la consulta'”.
Este ponente destacó que es importante respetar la cadena de frio en este medicamento. Es un fármaco que se inactiva cuando se pierde esta cadena durante un espacio de 72 horas. horas. Si no se utiliza al cabo de unos días y no se guarda en la nevera, pierde eficacia.
E insistió: “Hay que decirles a los pacientes que deben conservar el medicamento en la nevera una vez adquirido en la farmacia”.
(Clique aquí para ver los dibujos en un tamaño mayor)
CONCLUSIONES
-Alprostadilo tópico es una alternativa importante en el manejo de la disfunción eréctil.
-Idóneo como tratamiento de primera línea en pacientes con DE no severa que no han recibido tratamiento previo.
-La mejora de la DE con Alprostadilo en crema es a corto y largo plazo, con un inicio rápido de acción, lo que facilita las relaciones sexuales espontáneas.
-No interacciona con otros fármacos, ni con alimentos ni con alcohol porque no tiene absorción sistémica.
-Se puede usar en un amplio rango de pacientes.
-No tiene efectos adversos sistémicos y si los tiene son locales y poco relevantes.
-Es fácil de usar pero conviene educar a los pacientes en su utilización.
-“Elegir al paciente y adiestrarlo convenientemente en su uso -concluye el Dr. Moncada- será clave también en la buena respuesta del fármaco”.
REFERENCIAS
1) Hanchanale V., Eardley I. Alprostadil for the treatment of impotence. Expert Opin Pharmacother 2014;15:421-428.
2) de Tejada IS. Molecular mechanisms for the regulation of penile smooth muscle contractility. Int J Impot Res 2002;14:Suppl1,S6–S10.;
3) Becher E. Topical alprostadil cream for the treatment of erectile dysfunction. Expert Opin Pharmacother. 2004;5(3):623-32.
4) Moncada I, Cuzin B, et al. Clinical effica cy and safety of VITAROS©/VIRIREC© (alprostadil cream) for the treatment of erectile dysfunction.
Urologia. 2015 Apr-Jun;82(2):84-92
5) Wolka AM, Rytting JH, Reed BL, et al. The interaction of the penetration enhancer DDAIP with a phospholipid model membrane. Int J Pharm
2004;1;271(1-2):5-10.
6) Becher E. Topical alprostadil cream for the treatment of erectile dysfunction. Expert Opin Pharmacother 2004;5:623-632.
7) Padma-Nathan H, Steidle C, Salem S, Tayse N, Yeager J, Harning R. The efficacy and safety of a topical alprostadil cream, Alprox-TD,
for the treatment of erectile dysfunction: two phase 2 studies in mild-to-moderate and severe ED. Int J Impot Res. 2003 Feb;15(1):10-7.
8) Padma-Nathan H, Yeager JL. An integrated analysis of alprostadil topical cream for the treatment of erectile dysfunction in 1732
patients. Urology 2006;68:386-391.
FICHA TÉCNICA (clique aquí para verla en PDF)
2014. 1. NOMBRE DEL MEDICAMENTO. Virirec 2 mg/g crema. Virirec 3 mg/g crema. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA. Cada envase de un solo uso contiene 200 μg de alprostadilo en 100 mg de crema (2 mg/g). Cada envase de un solo uso contiene 300 μg de alprostadilo en 100 mg de crema (3 mg/g). Para consultar la lista completa de excipientes ver sección 6.1. 3. FORMA FARMACÉUTICA. Crema. Virirec es una crema de color blanco a blanco mate suministrada en AccuDose, un envase monodosis. AccuDose es un envase que consta de un émbolo, un cilindro y una cápsula de cierre protectora y va contenido en un sobre protector. 4. DATOS CLÍNICOS. 4.1. Indicaciones terapéuticas. Tratamiento de hombres ≥ 18 años de edad con disfunción eréctil, incapaces de lograr o mantener una erección peneana adecuada para un desempeño sexual satisfactorio. 4.2. Posología y forma de administración. Virirec se aplica en la punta del pene. Virirec está disponible en dosis de 200 y 300 μg de alprostadilo en 100 mg de crema. Virirec debe usarse cuando sea necesario para lograr una erección. Cada envase AccuDose de Virirec es de un solo uso y se debe eliminar de forma apropiada después del mismo. El comienzo del efecto ocurre en el plazo de 5 a 30 minutos tras la administración. La duración del efecto es de aproximadamente entre 1 y 2 horas. Sin embargo, la duración real será variable entre los pacientes. Un profesional médico deberá instruir a cada paciente acerca de la técnica adecuada para la administración de Virirec antes de la autoadministración. La máxima frecuencia de uso no debe exceder de 2 a 3 veces por semana y solamente una vez por cada periodo de 24 horas. Un médico debe recomendar la dosis inicial. Una dosis inicial de 300 μg puede considerarse especialmente en pacientes con disfunción eréctil grave, comorbilidad o fracaso a los inhibidores de PDE-5. En aquellos pacientes que no toleran una dosis de 300 μg debido a reacciones adversas, puede valorarse el uso de la dosis más baja de 200 μg. Los pacientes deben recibir las instrucciones sobre la técnica de administración adecuada, información sobre posibles efectos adversos, p. ej., mareos, desfallecimientos, y la necesidad de evitar el manejo de maquinaria hasta que están seguros de su tolerancia al fármaco. En el ensayo clínico hubo una tasa de retirada más alta en el grupo tratado con 300 μg en comparación con el grupo de 200 μg, 30% en comparación con 20%, respectivamente. Forma de administración. Aplique Virirec en la punta del pene (meato) en el plazo de 5 y 30 minutos antes de intentar el coito siguiendo las instrucciones indicadas a continuación: 1. Lávese las manos antes de aplicar Virirec. Retirar el envase AccuDose del sobre rasgando completamente el cierre desde el centro hasta el borde superior. Retirar el envase AccuDose del sobre. Guardar el sobre para eliminar posteriormente el envase de AccuDose utilizado. Retirar la cápsula del cierre de la punta del envase Ver Fig. 1. 2. Tomar la punta del pene con una mano y manipularlo ligeramente para ampliar el orificio del pene. Ver Fig. 2 (nota: si usted no está circuncidado, primeramente retirar y mantener retraído el prepucio 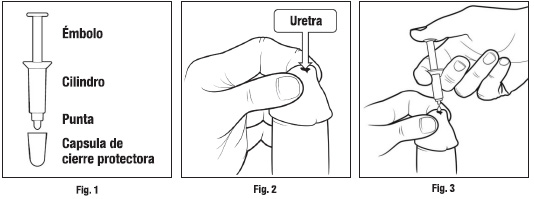 antes de ampliar el orificio del pene). 3. Sostener el cilindro del envase AccuDose entre sus dedos y colocar la punta del envase sobre la apertura del pene y cuidadosamente empujar el émbolo con el pulgar hasta que salga toda la crema del cilindro del envase AccuDose y se encuentre en el orificio y en la piel circundante (Fig. 3). Nota: no insertar la cápsula del cierre de la punta del envase AccuDose en el orificio del pene. 4. Mantener el pene en una posición erecta durante aproximadamente 30 segundos para permitir la penetración de la crema. Es probable que haya un poco de crema que no quepa en el orificio del pene. La cantidad de crema adicional será variable dependiendo del paciente y no es inusual que la mitad de la dosis se quede en la orilla del orificio. No utilizar un segundo envase AccuDose para compensar la crema no dispensada dentro del orificio del pene. Cualquier exceso de crema que cubra el orificio del pene se puede frotar suavemente con la punta de un dedo hacia el interior del propio orificio y sobre la piel que rodea el lugar de aplicación. 5. Recordar que cada dosis de Virirec es adecuada solo para una administración. Colocar nuevamente la cápsula de cierre en el envase AccuDose y depositar dentro del sobre abierto, envolver y eliminar de acuerdo con la normativa local. 6. Virirec podría irritar los ojos. Lávese las manos después de aplicar Virirec. 4.3. Contraindicaciones. Virirec no debe usarse en pacientes con alguno de los siguientes trastornos: -Trastornos subyacentes como hipotensión ortostática, infarto de miocardio y síncope. -Hipersensibilidad conocida a alprostadilo o a cualquiera de los ingredientes de Virirec. -Enfermedades que podrían predisponer a priapismo, como anemia o rasgo de células falciformes, trombocitopenia, policitemia o mieloma múltiple, o leucemia. -Anatomía anormal del pene como hipospadias graves, en pacientes con deformación anatómica del pene, como curvatura y en pacientes con uretritis y balanitis (inflamación/infección del glande del pene). -Propensión a la trombosis venosa o antecedentes de síndrome de hiperviscosidad y que, por lo tanto, tienen un riesgo incrementado de priapismo (erección rígida con duración de 4 horas o más). -Virirec no debe usarse en pacientes en quienes no se recomienda la actividad sexual, como en hombres con enfermedades cardiovasculares o cerebrovasculares inestables. -Virirec no debe utilizarse durante el coito con una mujer potencialmente fértil a menos que la pareja utilice un condón. 4.4. Advertencias y precauciones especiales de empleo. Efectos locales: En casos raros, se han observado erecciones prolongadas con una duración > 4 horas (priapismo). Se observó priapismo en los dos estudios de 3 meses en 1 paciente (0,06%) y en el estudio > 6 meses en 5 (0,4%) pacientes, incluidos 4 pacientes (0,3%) en el grupo de 200 μg y en 1 paciente (0,1%) en el grupo de 300 μg. Si ocurre priapismo, el paciente deberá buscar ayuda médica de inmediato. Si el priapismo no se trata de inmediato, se podría ocasionar daño al tejido peneano y una pérdida permanente de potencia. Durante la dosificación en los estudios de fase III, la hipotensión sintomática (mareos) y síncope ocurrieron en un pequeño porcentaje de los pacientes (2 de 459 (0,4%), 6 de 1.591 (0,4%) y 6 de 1.280 (0,5%) pacientes con las dosis de 100, 200 y 300 μg de alprostadilo, respectivamente. Se debe advertir a los pacientes que deben evitar actividades como la conducción de vehículos o las tareas peligrosas, donde podrían presentarse lesiones si ocurre hipotensión o síncope después de la administración de Virirec. Antes del inicio del tratamiento con Virirec, las causas tratables de la disfunción eréctil deberán excluirse a través de métodos adecuados de diagnóstico. Además, los pacientes con trastornos subyacentes, como hipotensión ortostática, infarto de miocardio y síncope no deberán usar Virirec (ver CONTRAINDICACIONES, sección 4.3). No se han realizado estudios clínicos en pacientes con antecedentes de enfermedades neurológicas o lesiones de la médula espinal. No se ha estudiado formalmente la farmacocinética de Virirec en pacientes con insuficiencia hepática y/o renal. Se podría necesitar una reducción de la dosis en estas poblaciones debido a la alteración del metabolismo. Precauciones generales: Virirec debe aplicarse según las instrucciones anteriores. La exposición intrauretral inadvertida podría ocasionar ardor en el pene o sensación de hormigueo y dolor. No se conoce la exposición intrauretral repetida a largo plazo de Virirec. Se debe informar a los pacientes que Virirec no ofrece protección frente a las enfermedades de transmisión sexual. Se debe aconsejar a los pacientes y las parejas que utilizan Virirec acerca de las medidas necesarias de seguridad para la protección contra la diseminación de los agentes transmitidos sexualmente, incluido el virus de la inmunodeficiencia humana (VIH). Los profesionales sanitarios deben recomendar a sus pacientes informar a sus parejas sexuales que están utilizando Virirec. Las parejas de los usuarios de Virirec pueden experimentar efectos adversos, con mayor frecuencia irritación vaginal. Por lo tanto, se recomienda el uso de un condón. No se han estudiado los efectos de Virirec sobre la mucosa oral o anal. Se deberá utilizar un condón para el sexo oral (felación) o el sexo anal. Virirec no tiene propiedades anticonceptivas. Se recomienda que las parejas que utilizan Virirec usen anticonceptivos adecuados si la pareja femenina está en edad fértil. No existe información sobre los efectos de alprostadilo en el embarazo prematuro en los niveles que reciben las parejas femeninas. Se debe utilizar un condón durante las relaciones sexuales con una mujer en edad fértil, embarazada o en lactancia. Solamente se ha investigado el uso del medicamento con condones basados en material de látex; en otros materiales no se podría excluir el posible riesgo de que se deteriore el condón. 4.5. Interacción con otros medicamentos y otras formas de interacción. No se han realizado estudios de interacción farmacocinética o farmacodinámica con Virirec. Dada la naturaleza del metabolismo (ver “Farmacocinética”) las interacciones farmacológicas se consideran improbables. Efecto de interacción. No se ha estudiado la toxicidad ni la eficacia de Virirec en combinación con otros tratamientos para la disfunción eréctil, especialmente para el tratamiento con inhibidores de fosfodiesterasa 5 (PDE-5) o sildenafilo, tadalafilo y vardenafilo. Por lo tanto, Virirec no debe usarse en combinación con los inhibidores de PDE-5. Puesto que tanto Virirec como los inhibidores de PDE-5 tienen efectos cardiovasculares, no puede excluirse un riesgo cardiovascular aumentado. No se han realizado estudios de interacción de Virirec en combinación con implantes peneanos o relajantes del músculo liso, como papaverina, fármacos usados para inducir erecciones, como los fármacos alfa bloqueadores (p. ej., fentolamina, timoxamina por vía intracavernosa). Existe un riesgo de priapismo (erección dolorosa anormal prolongada) cuando se usa en combinación. No se han realizado estudios de interacción de Virirec en combinación con simpaticomiméticos, descongestivos y supresores del apetito. Cuando se usa en combinación, podría haber un efecto disminuido de alprostadilo (inhibición por interacción farmacológica). No se han realizado estudios de interacción de Virirec en combinación con anticoagulantes e inhibidores de la agregación plaquetaria. Cuando se usa en combinación, podría haber un riesgo incrementado de sangrado uretral, hematuria. Los pacientes tratados de forma concomitante con fármacos antihipertensivos y medicamentos vasoactivos, podrían mostrar un riesgo incrementado de hipotensión, especialmente en los pacientes de edad avanzada. 4.6. Fertilidad, embarazo y lactancia. Embarazo. No hay datos relativos al uso de alprostadilo en mujeres embarazadas. La exposición indirecta de alprostadilo en mujeres es probablemente baja. Los datos en animales con dosis más altas de alprostadilo mostraron toxicidad para la reproducción (ver sección 5.3). Las mujeres embarazadas no deben exponerse a Virirec. Lactancia. No se sabe si la exposición indirecta a alprostadilo mediante Virirec pueda conducir a una excreción significativa en la leche materna. No se recomienda el uso de Virirec durante la lactancia. Fertilidad. En conejos machos, se observó la atrofia de los túbulos seminíferos de los testículos tras la dosificación repetida. No se conoce si Virirec tiene un efecto sobre la fertilidad masculina humana. 4.7. Efectos sobre la capacidad para conducir y utilizar máquinas. No se han realizado estudios relativos a los efectos sobre la capacidad para conducir y utilizar máquinas. Debido a que en raras ocasiones se ha informado de mareos y síncopes (desfallecimientos) en los ensayos clínicos con Virirec, los pacientes deberán evitar actividades como la conducción de vehículos o las tareas peligrosas, donde pueden presentarse lesiones si ocurre un síncope dentro del plazo de 1 a 2 horas tras la administración de Virirec. 4.8. Reacciones adversas. Lista tabulada de reacciones adversas. Las reacciones adversas informadas con mayor frecuencia en el tratamiento con Virirec se presentan en la siguiente tabla (Muy frecuentes ≥ 1/10; frecuentes ≥ 1/100, <1/10; poco frecuentes ≥1/1.000, <1/100; raras ≥1/10.000, <1/1.000; muy raras <1/10.000). El priapismo (una erección que dura más de 4 horas) es un trastorno grave que requiere tratamiento médico inmediato.
antes de ampliar el orificio del pene). 3. Sostener el cilindro del envase AccuDose entre sus dedos y colocar la punta del envase sobre la apertura del pene y cuidadosamente empujar el émbolo con el pulgar hasta que salga toda la crema del cilindro del envase AccuDose y se encuentre en el orificio y en la piel circundante (Fig. 3). Nota: no insertar la cápsula del cierre de la punta del envase AccuDose en el orificio del pene. 4. Mantener el pene en una posición erecta durante aproximadamente 30 segundos para permitir la penetración de la crema. Es probable que haya un poco de crema que no quepa en el orificio del pene. La cantidad de crema adicional será variable dependiendo del paciente y no es inusual que la mitad de la dosis se quede en la orilla del orificio. No utilizar un segundo envase AccuDose para compensar la crema no dispensada dentro del orificio del pene. Cualquier exceso de crema que cubra el orificio del pene se puede frotar suavemente con la punta de un dedo hacia el interior del propio orificio y sobre la piel que rodea el lugar de aplicación. 5. Recordar que cada dosis de Virirec es adecuada solo para una administración. Colocar nuevamente la cápsula de cierre en el envase AccuDose y depositar dentro del sobre abierto, envolver y eliminar de acuerdo con la normativa local. 6. Virirec podría irritar los ojos. Lávese las manos después de aplicar Virirec. 4.3. Contraindicaciones. Virirec no debe usarse en pacientes con alguno de los siguientes trastornos: -Trastornos subyacentes como hipotensión ortostática, infarto de miocardio y síncope. -Hipersensibilidad conocida a alprostadilo o a cualquiera de los ingredientes de Virirec. -Enfermedades que podrían predisponer a priapismo, como anemia o rasgo de células falciformes, trombocitopenia, policitemia o mieloma múltiple, o leucemia. -Anatomía anormal del pene como hipospadias graves, en pacientes con deformación anatómica del pene, como curvatura y en pacientes con uretritis y balanitis (inflamación/infección del glande del pene). -Propensión a la trombosis venosa o antecedentes de síndrome de hiperviscosidad y que, por lo tanto, tienen un riesgo incrementado de priapismo (erección rígida con duración de 4 horas o más). -Virirec no debe usarse en pacientes en quienes no se recomienda la actividad sexual, como en hombres con enfermedades cardiovasculares o cerebrovasculares inestables. -Virirec no debe utilizarse durante el coito con una mujer potencialmente fértil a menos que la pareja utilice un condón. 4.4. Advertencias y precauciones especiales de empleo. Efectos locales: En casos raros, se han observado erecciones prolongadas con una duración > 4 horas (priapismo). Se observó priapismo en los dos estudios de 3 meses en 1 paciente (0,06%) y en el estudio > 6 meses en 5 (0,4%) pacientes, incluidos 4 pacientes (0,3%) en el grupo de 200 μg y en 1 paciente (0,1%) en el grupo de 300 μg. Si ocurre priapismo, el paciente deberá buscar ayuda médica de inmediato. Si el priapismo no se trata de inmediato, se podría ocasionar daño al tejido peneano y una pérdida permanente de potencia. Durante la dosificación en los estudios de fase III, la hipotensión sintomática (mareos) y síncope ocurrieron en un pequeño porcentaje de los pacientes (2 de 459 (0,4%), 6 de 1.591 (0,4%) y 6 de 1.280 (0,5%) pacientes con las dosis de 100, 200 y 300 μg de alprostadilo, respectivamente. Se debe advertir a los pacientes que deben evitar actividades como la conducción de vehículos o las tareas peligrosas, donde podrían presentarse lesiones si ocurre hipotensión o síncope después de la administración de Virirec. Antes del inicio del tratamiento con Virirec, las causas tratables de la disfunción eréctil deberán excluirse a través de métodos adecuados de diagnóstico. Además, los pacientes con trastornos subyacentes, como hipotensión ortostática, infarto de miocardio y síncope no deberán usar Virirec (ver CONTRAINDICACIONES, sección 4.3). No se han realizado estudios clínicos en pacientes con antecedentes de enfermedades neurológicas o lesiones de la médula espinal. No se ha estudiado formalmente la farmacocinética de Virirec en pacientes con insuficiencia hepática y/o renal. Se podría necesitar una reducción de la dosis en estas poblaciones debido a la alteración del metabolismo. Precauciones generales: Virirec debe aplicarse según las instrucciones anteriores. La exposición intrauretral inadvertida podría ocasionar ardor en el pene o sensación de hormigueo y dolor. No se conoce la exposición intrauretral repetida a largo plazo de Virirec. Se debe informar a los pacientes que Virirec no ofrece protección frente a las enfermedades de transmisión sexual. Se debe aconsejar a los pacientes y las parejas que utilizan Virirec acerca de las medidas necesarias de seguridad para la protección contra la diseminación de los agentes transmitidos sexualmente, incluido el virus de la inmunodeficiencia humana (VIH). Los profesionales sanitarios deben recomendar a sus pacientes informar a sus parejas sexuales que están utilizando Virirec. Las parejas de los usuarios de Virirec pueden experimentar efectos adversos, con mayor frecuencia irritación vaginal. Por lo tanto, se recomienda el uso de un condón. No se han estudiado los efectos de Virirec sobre la mucosa oral o anal. Se deberá utilizar un condón para el sexo oral (felación) o el sexo anal. Virirec no tiene propiedades anticonceptivas. Se recomienda que las parejas que utilizan Virirec usen anticonceptivos adecuados si la pareja femenina está en edad fértil. No existe información sobre los efectos de alprostadilo en el embarazo prematuro en los niveles que reciben las parejas femeninas. Se debe utilizar un condón durante las relaciones sexuales con una mujer en edad fértil, embarazada o en lactancia. Solamente se ha investigado el uso del medicamento con condones basados en material de látex; en otros materiales no se podría excluir el posible riesgo de que se deteriore el condón. 4.5. Interacción con otros medicamentos y otras formas de interacción. No se han realizado estudios de interacción farmacocinética o farmacodinámica con Virirec. Dada la naturaleza del metabolismo (ver “Farmacocinética”) las interacciones farmacológicas se consideran improbables. Efecto de interacción. No se ha estudiado la toxicidad ni la eficacia de Virirec en combinación con otros tratamientos para la disfunción eréctil, especialmente para el tratamiento con inhibidores de fosfodiesterasa 5 (PDE-5) o sildenafilo, tadalafilo y vardenafilo. Por lo tanto, Virirec no debe usarse en combinación con los inhibidores de PDE-5. Puesto que tanto Virirec como los inhibidores de PDE-5 tienen efectos cardiovasculares, no puede excluirse un riesgo cardiovascular aumentado. No se han realizado estudios de interacción de Virirec en combinación con implantes peneanos o relajantes del músculo liso, como papaverina, fármacos usados para inducir erecciones, como los fármacos alfa bloqueadores (p. ej., fentolamina, timoxamina por vía intracavernosa). Existe un riesgo de priapismo (erección dolorosa anormal prolongada) cuando se usa en combinación. No se han realizado estudios de interacción de Virirec en combinación con simpaticomiméticos, descongestivos y supresores del apetito. Cuando se usa en combinación, podría haber un efecto disminuido de alprostadilo (inhibición por interacción farmacológica). No se han realizado estudios de interacción de Virirec en combinación con anticoagulantes e inhibidores de la agregación plaquetaria. Cuando se usa en combinación, podría haber un riesgo incrementado de sangrado uretral, hematuria. Los pacientes tratados de forma concomitante con fármacos antihipertensivos y medicamentos vasoactivos, podrían mostrar un riesgo incrementado de hipotensión, especialmente en los pacientes de edad avanzada. 4.6. Fertilidad, embarazo y lactancia. Embarazo. No hay datos relativos al uso de alprostadilo en mujeres embarazadas. La exposición indirecta de alprostadilo en mujeres es probablemente baja. Los datos en animales con dosis más altas de alprostadilo mostraron toxicidad para la reproducción (ver sección 5.3). Las mujeres embarazadas no deben exponerse a Virirec. Lactancia. No se sabe si la exposición indirecta a alprostadilo mediante Virirec pueda conducir a una excreción significativa en la leche materna. No se recomienda el uso de Virirec durante la lactancia. Fertilidad. En conejos machos, se observó la atrofia de los túbulos seminíferos de los testículos tras la dosificación repetida. No se conoce si Virirec tiene un efecto sobre la fertilidad masculina humana. 4.7. Efectos sobre la capacidad para conducir y utilizar máquinas. No se han realizado estudios relativos a los efectos sobre la capacidad para conducir y utilizar máquinas. Debido a que en raras ocasiones se ha informado de mareos y síncopes (desfallecimientos) en los ensayos clínicos con Virirec, los pacientes deberán evitar actividades como la conducción de vehículos o las tareas peligrosas, donde pueden presentarse lesiones si ocurre un síncope dentro del plazo de 1 a 2 horas tras la administración de Virirec. 4.8. Reacciones adversas. Lista tabulada de reacciones adversas. Las reacciones adversas informadas con mayor frecuencia en el tratamiento con Virirec se presentan en la siguiente tabla (Muy frecuentes ≥ 1/10; frecuentes ≥ 1/100, <1/10; poco frecuentes ≥1/1.000, <1/100; raras ≥1/10.000, <1/1.000; muy raras <1/10.000). El priapismo (una erección que dura más de 4 horas) es un trastorno grave que requiere tratamiento médico inmediato.


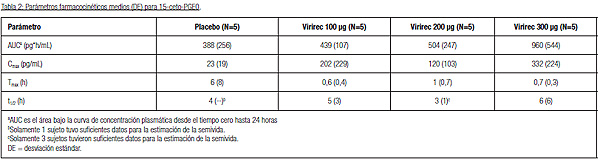
Poblaciones especiales. *No existe una indicación clara de que alprostadilo aumente el riesgo de efectos cardiovasculares, distintos a los efectos vasodilatadores, pero no puede excluirse que los pacientes con enfermedad subyacente/factores de riesgo presenten un riesgo aumentado en combinación con el aumento de la actividad sexual/física asociada con el uso de alprostadilo (ver 4.3 y 4.4). Notificación de sospechas de reacciones adversas. Es importante notificar las sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del Sistema Español de Farmacovigilancia de Medicamentos de Uso Humano: https://www.notificaram.es. 4.9. Sobredosis. No se ha informado sobredosis que requiera tratamiento con Virirec. La sobredosis con Virirec puede provocar hipotensión, síncope, mareos, dolor de pene y posible priapismo (erección rígida con duración >4 horas). El priapismo puede provocar un deterioro permanente de la función eréctil. Los pacientes con sospecha de sobredosis que desarrollan estos síntomas deberán estar bajo supervisión médica hasta que los síntomas generalizados o locales se hayan resuelto. Si se presenta una erección prolongada con duración de 4 o más horas, se debe aconsejar al paciente buscar ayuda médica. Se deben tomar las siguientes medidas: -El paciente debe estar en posición supina o acostarse de lado. Aplicar una bolsa de hielo alternando durante dos minutos en cada una de las caras internas de los muslos superiores (esto produce un reflejo que ocasiona la apertura de las válvulas venosas). Si no hay una respuesta después de 10 minutos, interrumpa el tratamiento. -Si este tratamiento es ineficaz y la rigidez de la erección ha durado más de 6 horas, se deberá realizar una aspiración peneana. Mediante el uso de una técnica aséptica, insertar una aguja mariposa de medida estándar 19-21 dentro del cuerpo cavernoso y aspirar entre 20-50 mililitros de sangre. Esto deberá desentumecer el pene. En caso necesario, el procedimiento podrá repetirse sobre el lado opuesto del pene. -Si aún no se tiene éxito, se recomienda la inyección intracavernosa de un medicamento α-adrenérgico. Aunque la contraindicación general para la administración intrapeneana de un vasoconstrictor no se aplica en el tratamiento de priapismo, se aconseja tener precaución cuando se pone en práctica esta opción. La presión arterial y el pulso deben comprobarse de forma continua durante este procedimiento. Se requiere precaución extrema en los pacientes con enfermedad cardíaca coronaria, hipertensión no controlada, isquemia cerebral y en los sujetos que toman inhibidores de monoaminooxidasa. En este último caso, se deben tener instalaciones disponibles para manejar una crisis hipertensiva. -Se debe preparar una solución de 200 μg/ml de fenilefrina y se deben inyectar 0,5 a 1,0 ml de la solución cada 5-10 minutos. Como alternativa, se puede utilizar una solución de 20 μg de adrenalina. En caso necesario, después de esto último se debe continuar además con una aspiración de la sangre a través de la misma aguja mariposa. La dosis máxima de fenilefrina debe ser de 1 mg o de 100 μg de adrenalina (5 ml de la solución). -Como alternativa, se puede utilizar metaraminol, pero debe tenerse en cuenta que se han comunicado crisis hipertensivas mortales. Si esto aún fracasa para resolver el priapismo, se debe remitir de inmediato al paciente para su manejo quirúrgico. 5. PROPIEDADES FARMACOLÓGICAS. 5.1. Propiedades farmacodinámicas. Grupo farmacoterapéutico: fármacos usados en la disfunción eréctil Código ATC: G04BE01. Mecanismo de acción. El alprostadilo es químicamente idéntico a la prostaglandina E1, cuyas acciones incluyen la vasodilatación de los vasos sanguíneos en los tejidos eréctiles del cuerpo cavernoso y el aumento en el flujo sanguíneo arterial venoso, que ocasiona la rigidez peneana. Tras la aplicación de Virirec, el comienzo de la erección ocurre en el plazo de 5 a 30 minutos. El alprostadilo tiene una semivida corta en el hombre y la mejora de las erecciones puede durar entre 1 y 2 horas tras la administración. Eficacia. La eficacia de Virirec se evaluó en pacientes con disfunción eréctil en dos estudios pivotales de fase 3. Con respecto al placebo, se observó una mejora global estadísticamente significativa en los grupos de tratamiento con 100, 200 y 300 μg de alprostadilo en cada una de las variables primarias de eficacia, es decir, el dominio de la función eréctil (EF, por sus siglas en inglés) de la escala IIEF (International Index of Erectile Function) y aumentaron el éxito en la penetración vaginal y la eyaculación. Además, hubo también mejoría global y significación estadística de los grupos de tratamiento en comparación con el placebo en muchas de las variables secundarias de eficacia, incluidos los otros dominios de la escala IIEF (función orgásmica, satisfacción coital y satisfacción global), Patient Self-Assessment of Erection (PSAE) y Global Assessment Questionnaire (GAQ). Eficacia en la subpoblaciones. En general, en las subpoblaciones se observaron mejoría similares a las del total de pacientes (pacientes diabéticos, cardíacos, prostatectomizados, hipertensos y pacientes que habían fracasado anteriormente en la terapia con Viagra) y dos grupos etarios (< 65 y > 65 años) en el dominio EF de la escala IIEF. 5.2. Propiedades farmacocinéticas. Absorción. No se ha determinado la biodisponibilidad absoluta de la vía tópica. En un estudio farmacocinético, los pacientes con disfunción eréctil recibieron tratamiento con Virirec crema 100 mg en dosis de 100, 200 y 300 μg de alprostadilo. Los niveles plasmáticos de PEG1 y de su metabolito, PEG0, fueron bajos o indetectables en muchos de los sujetos en la mayoría de los tiempos de muestreo sanguíneo posteriores a la dosis y los parámetros farmacocinéticos no pudieron estimarse. Los valores de Cmax y de AUC de la 15-ceto-PGE0 fueron bajos y mostraron un aumento menor del proporcional a la dosis en el intervalo entre 100 y 300 μg. Las concentraciones plasmáticas máximas de la 15-ceto-PGE0 se alcanzaron en el plazo de una hora tras la administración.
Distribución. Tras la administración de alprostadilo en el meato y el glande, el alprostadilo se absorbe rápidamente en el cuerpo esponjoso y el cuerpo cavernoso a través de los vasos colaterales. La cantidad restante pasa hacia la circulación pélvica venosa a través de las venas que drenan el cuerpo esponjoso. Biotransformación. Tras la administración tópica, la PGE1 se metaboliza rápidamente a 15-ceto-PGE1 de forma local mediante la oxidación enzimática del grupo 15-hidroxilo. La 15-ceto-PGE1 retiene solamente entre el 1% y el 2% de la actividad biológica de la PGE1 y se reduce rápidamente a la forma del metabolito inactivo más abundante, 13, 14-dihidro, 15-ceto-PGE, que se depura principalmente en el riñón y el hígado. Eliminación. Tras la administración intravenosa de alprostadilo marcado con tritio en hombres, el fármaco marcado desapareció rápidamente de la sangre en los primeros 10 minutos y tras una hora solo quedó en sangre una radiactividad de bajo nivel. Los metabolitos de alprostadilo se eliminan principalmente en los riñones con aproximadamente el 90% de la dosis administrada por vía intravenosa eliminada en la orina dentro del plazo de 24 horas tras la administración. El resto se elimina en las heces. No hay evidencia de la retención tisular de alprostadilo o de sus metabolitos tras la administración intravenosa. Farmacocinética en poblaciones especiales. Enfermedad pulmonar. Los pacientes con enfermedad pulmonar podrían tener una capacidad disminuida para la depuración del fármaco. En pacientes con síndrome de distress respiratorio del adulto, la extracción pulmonar de PEG1 administrado por vía intravenosa se redujo en aproximadamente 15% en comparación con un grupo control de pacientes con función respiratoria normal. Género. No se han estudiado los efectos del género sobre la farmacocinética de Virirec ni se han realizado estudios farmacocinéticos en las parejas femeninas. Población geriátrica, pediátrica. No se han estudiado los efectos etarios sobre la farmacocinética de alprostadilo tópico. Virirec no está indicado para su uso en niños o en individuos menores de 18 años de edad. 5.3. Datos preclínicos sobre seguridad. Alprostadilo, DDAIP y Virirec (incluido DDAIP) no han mostrado potencial genotóxico. No se han realizado estudios de carcinogenicidad con alprostadilo o Virirec. Las evaluaciones de carcinogenicidad del excipiente, DDAIP, no encontraron formación de tumores con la administración tópica a ratones y la administración subcutánea en ratas. En el modelo de administración de DDAIP en ratones transgénicos Tg.AC se indujeron papilomas a una concentración de 1,0% y 2,5% en hembras y machos, respectivamente. Es probable que este efecto no sea relevante en seres humanos, ya que probablemente es causado por irritación. Alprostadilo no tiene efectos sobre el recuento o la morfología de los espermatozoides. Sin embargo, el excipiente DDAIP ocasionó atrofia de los túbulos seminíferos de los testículos en conejos cuando se administró localmente a una concentración del 5%. No se pudo evaluar un efecto espermatotóxico directo del DDAIP y, por lo tanto, se no se conoce la relevancia relativa a una posible reducción en la fertilidad masculina en seres humanos. El DDAIP administrado subcutáneamente a ratas no tuvo efecto sobre la fertilidad. Se ha demostrado que alprostadilo es embriotóxico (peso fetal disminuido) cuando se administró como bolo subcutáneo en ratas preñadas en dosis bajas. En dosis altas provocó un incremento en las resorciones, redujo el número de fetos vivos, aumentó las incidencias de variaciones viscerales y esqueléticas, y malformaciones, y de la toxicidad materna. La administración intravaginal de la PGE1 en conejos preñados no ocasionó daños en los fetos. Se realizaron estudios de toxicidad para reproducción con DDAIP tras la administración subcutánea en ratas y conejos. No se observaron efectos en ratas, pero en conejos se observó fetotoxicidad, incluyendo malformaciones, con dosis altas, probablemente atribuidas a toxicidad materna. No hubo efectos evidentes sobre el desarrollo posnatal en ratas. 6.DATOS FARMACÉUTICOS. 6.1.Lista de excipientes. Agua purificada. Etanol, anhidro. Etillaureato. Hidroxipropil goma guar. Hidrocloruro de dodecil-2-N,N-dimetilaminopropionato. Dihidrogenofosfato de potasio. Hidróxido de sodio, para el ajuste del pH. Ácido fosfórico, para el ajuste del pH. 6.2. Incompatibilidades. No procede. 6.3. Periodo de validez. 9 meses para Virirec 2 mg/g crema. 18 meses para Virirec 3 mg/g crema. Una vez abierto, usar de inmediato, eliminar cualquier porción no utilizada. 6.4. Precauciones especiales de conservación. Conservar en nevera (entre 2 ºC y 8 ºC). No congelar. El paciente puede mantener los sobres no abiertos fuera de la nevera, a una temperatura por debajo de 25 °C hasta 3 días antes del uso. Al final de este periodo, el producto debe eliminarse si no se utiliza. Conservar en el sobre original para protegerlo de la luz. 6.5. Naturaleza y contenido del envase. Virirec se suministra en sobres individuales que contienen un (1) envase AccuDose. Cada envase individual contiene 100 mg de crema. Virirec está disponible en cajas unitarias que contienen cuatro (4) envases. Los sobres se componen de laminado/película de aluminio. Los componentes del envase son polipropileno y polietileno. 6.6. Precauciones especiales de eliminación. Cada envase AccuDose de Virirec es de un solo uso. La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él, se realizará de acuerdo con la normativa local. 7. PRESENTACIONES Y P.V.P.(IVA): VIRIREC 3mg/g con 4 envases monodosis. -P.V.P. I.V.A: 46,83 €. 8. CONDICIONES DE PRESCRIPCIÓN Y DISPENSACIÓN: Medicamento sujeto a prescripción médica. No reembolsado por el Sistema Nacional de Salud. 9. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN. Recordati Ireland Ltd. Raheens East. Rengaskiddy Co. Cork. Irlanda. 10. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN. Virirec. 2mg/g crema.78356. Virirec 3 mg/g crema. 78357. 11 FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN. Abril 2014. 12. FECHA DE LA REVISIÓN DEL TEXTO. Agosto 2014