Redacción Farmacosalud.com
La compañía Novartis ha anunciado que ‘The New England Journal of Medicine’ (NEJM) ha publicado datos de PKC412 (midostaurin) que demuestran una tasa de respuesta global, definida como una respuesta total o parcial, del 60% (intervalo de confianza [IC] 95%, 49-70%; P<0,001) en pacientes con mastocitosis sistémica (MS) avanzada. La mediana de duración de la respuesta para todos los que respondieron en la población de eficacia primaria fue de 24,1 meses (IC 95%, 10,8-no estimado [NE])[1]. La MS avanzada es una enfermedad rara que se caracteriza por la acumulación de mastocitos anormales, un tipo de glóbulo blanco, en médula ósea, hígado, bazo y otros órganos, lo que provoca daño orgánico. También se caracteriza por la activación frecuente de mutaciones del gen KIT[5]. Los pacientes con MS avanzada tienen mal pronóstico; la supervivencia global oscila entre menos de 6 meses a 3,5 años, según el subtipo[2,3], y actualmente no hay ningún tratamiento aprobado para la mayoría de los pacientes[4,5].
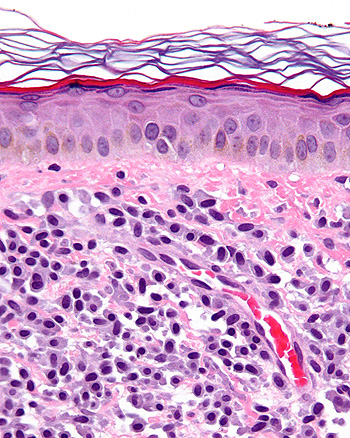
Micrografía de una mastocitosis. Biopsia de piel. Tinción hematoxilina-eosina
Autor/a de la imagen: Nephron
Fuente: Wikipedia
El estudio clínico de Fase II CPKC412D2201 ha sido el ensayo prospectivo más largo y extenso realizado sobre este raro trastorno. Jason Gotlib, médico de la Stanford University School of Medicine y el Stanford Cancer Institute, participó como investigador principal del trabajo, en el que se reclutó a 116 personas con MS avanzada. Un comité de dirección del estudio se encargó de supervisar la idoneidad y las respuestas y 89 pacientes fueron seleccionados para la población de eficacia primaria. Los pacientes recibieron PKC412 (midostaurin) oral en monoterapia hasta la progresión de la enfermedad o toxicidad inaceptable. Los resultados demostraron una mediana de la supervivencia global (SG) de 28,7 meses (IC 95%, 18,1-NE). Se detectaron mejoras en la carga mastocítica de la médula ósea y los niveles de triptasa en suero (un marcador de la carga mastocítica) en el 78% de los pacientes, y se asociaron a una regresión de la enfermedad[1].
"Si se aprueba, midostaurin ofrecerá una opción de tratamiento muy necesaria"
"Estos datos muestran una clara mejoría de la enfermedad y los síntomas con el tratamiento oral con midostaurin en participantes del estudio que reflejan la heterogeneidad de la enfermedad", sostiene el profesor Andreas Reiter, del Departamento de Hematología y Oncología del Hospital Universitario Mannheim de la Universidad de Heidelberg, Alemania y autor principal del estudio. "Si se aprueba, midostaurin les ofrecerá a los pacientes una opción de tratamiento muy necesaria".
Los efectos secundarios más frecuentes fueron gastrointestinales. A excepción de las náuseas y vómitos, los 32 síntomas declarados en la Escala de Evaluación de Síntomas del Memorial disminuyeron significativamente con el tratamiento (P<0,001). La calidad de vida, evaluada con la versión reducida de 12 preguntas del Cuestionario de Salud (SF-12), también aumentó significativamente con el tratamiento con PKC412 (midostaurin), comparado con los valores en valor basal: la mejora se manifestó en un aumento del 26% (P<0,001) de la puntuación en salud mental y del 29% (P<0,001) de la puntuación de salud física[1].
Los resultados del estudio de Fase II también se han visto reforzados en una carta publicada en el mismo NEJM por el French Reference Centre of Mastocytosis (CEREMAST) acerca de un programa de uso compasivo de PKC412 (midostaurin) en MS avanzada[6]. Tras una mediana de tiempo de seguimiento de 18,5 (3-36) meses, la tasa de respuesta global al tratamiento fue del 71%. Tras un tiempo de seguimiento similar, la tasa de supervivencia global (SG) fue del 42,7%, comparada con el 14,9% en un grupo de control histórico comparado (P=0,03). También se observó un riesgo dos veces mayor de muerte en el grupo de control (HR 2,2; P=0,02)[6]. Los efectos secundarios más frecuentes fueron náuseas y vómitos en el 89% de los pacientes (que provocaron abandono del tratamiento en el 18%), linfopenia en el 61% sin infecciones oportunistas y fotosensibilidad en el 25%. Los autores llegaron a la conclusión de que PKC412 (midostaurin) es eficaz en MS avanzada[6].
(Imagen modificada) Autor/a del original: mconnors
Fuente: www.morguefile.com (free photo)
Un inhibidor de quinasas en investigación, oral y multidiana
PKC412 (midostaurin) es un inhibidor de quinasas en investigación, oral y multidiana que recibió recientemente la designación de terapia innovadora para adultos con leucemia mieloide aguda (LMA) con mutación de FLT3 recién diagnosticada de la US Food and Drug Administration (FDA). Además, PKC412 (midostaurin) posee designación de fármaco huérfano en la UE y EE.UU. para LMA y mastocitosis. Dado que PKC412 (midostaurin) se encuentra en investigación en este momento, Novartis abrió un Programa Global de Pacientes Individuales (programa de uso compasivo) para permitirle el acceso a PKC412 (midostaurin) a pacientes pediátricos y adultos con mastocitosis sistémica agresiva (MSA), leucemia mastocítica (LM) o sarcoma mastocítico (SM). Los médicos que deseen solicitar PKC412 (midostaurin) para pacientes aptos deberían ponerse en contacto con un representante médico de Novartis de sus respectivos países. En EE.UU., los pacientes pueden llamar al 1-888-NOW-NOVA (1-888-669-6682) para más información.
El estudio abierto de grupo único de Fase II en adultos (a partir de 18 años) incluía los siguientes subtipos de MS avanzada en la población de eficacia primaria: mastocitosis sistémica agresiva (MSA, N=16), leucemia mastocítica (LM, N=16) y MS con neoplasia hematológica asociada (MS-NHA, N=57)[1]. La SG era un objetivo secundario clave del estudio, que variaba según el subtipo: 20,7 meses (IC 95%, 16-44,4) en pacientes de MS-NHA y 9,4 meses (IC 95%, 7,5-NE) en pacientes de LM. La mediana de supervivencia global en pacientes con MSA no se alcanzó en el momento del análisis (IC 95%, 28,7 meses-NE). La mediana de la supervivencia libre de progresión (SLP) fue mayor en los pacientes de MSA (28,7 meses, IC 95%, 24,8-NE) que en los de MS-NHA (11 meses, IC 95%, 7,4-17.0) y LM (11,3 meses, IC 95%, 2,8-NE)[1]. Los acontecimientos adversos no hematológicos más frecuentes (>=50%) fueron náuseas (79%), vómitos (66%) y diarrea (54%). Los acontecimientos adversos no hematológicos más frecuentes de Grado 3/4 (>=8%) fueron cansancio (9%) y diarrea (8%). Se redujo la dosis por motivos de toxicidad en el 56% de los pacientes[1].
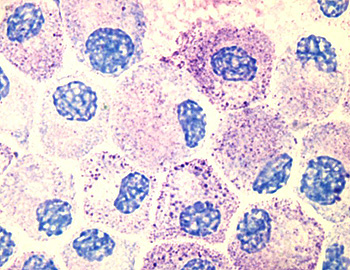
Imagen tomada con un microscopio óptico, en la que se observan mastocitos teñidos con azul de toluidina
Autor/a de la imagen: Kauczuk
Fuente: Wikipedia
Proliferación incontrolada de mastocitos: suele deberse a una mutación del gen KIT
La mastocitosis sistémica (MS) abarca un grupo de enfermedades raras que afectan a 1 de cada 20.000 a 40.000 personas en todo el mundo[7], en las que se produce crecimiento y acumulación incontrolada de mastocitos en uno o más órganos[5]. La proliferación incontrolada de mastocitos se debe en muchas personas a una mutación del gen KIT (la mutación más común, la sustitución en el codón D816V, se da aproximadamente en el 90% de los pacientes)[8]. La mutación del gen KIT provoca la activación de la enzima KIT, que desencadena la proliferación anormal y supervivencia de los mastocitos[7,9]. En la MS avanzada, el desarrollo incontrolado de mastocitos neoplásicos provoca daños orgánicos (como disfunción hepática), hemogramas bajos y pérdida de peso. Los pacientes también sufren síntomas sistémicos debilitantes como pruritos (picor severo de la piel), causados por mastocitos que liberan mediadores inflamatorios, como histamina, en la sangre[5]. La MS avanzada incluye subtipos de mastocitosis sistémica agresiva (MSA), leucemia mastocítica (LM) y MS con neoplasia hematológica asociada (MS-NHA)[4]. La mediana de supervivencia global es de 3,5 años, menos de 6 meses y 2 años para MSA, LM y MS-NHA, respectivamente[2,3].
Strimvelis®, autorizada para tratar ADA-SCID
Por otro lado, GlaxoSmithKline (GSK), Fondazione Telethon (Telethon) y Ospedale San Raffaele (OSR) han anunciado que la Comisión Europea ha aprobado Strimvelis®, la primera terapia génica de células madre ex-vivo para tratar a pacientes con una enfermedad muy rara llamada ADA-SCID (inmunodeficiencia combinada severa por déficit de adenosina deaminasa). Un niño que nace con ADA-SCID no posee un sistema inmunitario fuerte ni con buen funcionamiento y, por consiguiente, no es capaz de combatir las infecciones diarias. Strimvelis® (células CD34+ autólogas transducidas para expresar ADA) es la primera terapia génica correctiva para niños que obtiene la aprobación reglamentaria en el mundo. Está indicada para el tratamiento de pacientes con ADA-SCID para los que no exista un donante de células madres con HLA compatible. Se estima que esta enfermedad afecta a 15 niños al año en Europa y, tras la aprobación, los pacientes con ADA-SCID para los que se indica el tratamiento serán capaces de recibir la terapia génica en el Ospedale San Raffaele de Milán.
13 años hasta alcanzar un diagnóstico de angioedema hereditario
El Angioedema Hereditario (AEH) es una enfermedad rara de origen genético que afecta a 1 de cada 50.000 personas, alrededor de 1.000 personas en España, y que tarda en ser diagnosticada una media de trece años. Los síntomas son aparición de edemas o hinchazón en la piel o en las mucosas (en los casos laríngeos e intestinal) que aumentan progresivamente provocando dolores intensos, principalmente en extremidades, cara, laringe y pared intestinal. Según un estudio reciente[10], el 59% de los pacientes tienen un ataque al menos una vez al mes y un 24% experimenta un ataque en más de una localización. “Además de estos efectos físicos, es una patología que afecta considerablemente a la calidad de vida del paciente, creando ansiedad ante la incertidumbre de cuándo tendrá lugar el siguiente ataque, dónde se encontrará el paciente en ese momento y qué parte del cuerpo se verá afectada”, explica la doctora Mª Concepción López Serrano, alergóloga miembro de la Sociedad Española de Alergología e Inmunología Clínica (SEAIC) y cofundadora y vicepresidenta de AEDAF (Asociación Española de Angioedema Familiar).
Referencias
1. Gotlib J, Kluin-Nelemans HC, George TI, et al. Efficacy and Safety of Midostaurin in Advanced Systemic Mastocytosis. N Engl J Med. 2016;374(26):2530-2541.
2. Lim KH, Tefferi A, Lasho, et al. Systemic mastocytosis in 342 consecutive adults: survival studies and prognostic factors. Blood. 2009;113:5727-5736.
3. Georgin-Lavialle S, Lhermitte L, Dubreuil P, et al. Mast cell leukemia. Blood. 2013;121(8):1285-1295.
4. Arock M, Akin C, Hermine O. Current treatment options in patients with mastocytosis: status in 2015 and future. European Journal of Haematolgy. 2015;94(6):474-90.
5. Verstovsek S. Advanced systemic mastocytosis: the impact of KIT mutations in diagnosis, treatment, and progression. Eur J Haematol. 2013;90(2):89-98.
6. Chandesris MO, Damaj G, Hermine O, et al. Midostaurin in advanced systemic mastocytosis. N Engl J Med. 2016;374(26):2605-2606.
7. Orpha.net. Systemic Mastocytosis. http://www.orpha.net/consor/cgi-bin/OC_Exp.php?Expert=2467. Accessed March 2016.
8. Garcia-Montero AC, Jara-Acevedo M, Teodosi C, et al. KIT mutation in mast cells and other bone marrow hematopoietic cell lineages in systemic mast cell disorders: a prospective study of the Spanish Network on Mastocytosis (REMA) in a series of 113 patients. Blood. 2006;108(7):2366-2372.
9. Kristensen T, Vestergaard H, Møller MB. Improved detection of the KIT D816V mutation in patients with systemic mastocytosis using a quantitative and highly sensitive real-time qPCR assay. J Mol Diagn. 2011;13(2):180-8.
10. Teresa Caballero, M.D.; Ph.D., EmelAygoren-pursun, M.D., Anette Bygum, M.D, Kathleen Beusterien, M.P.H., Emily Hautamaki, MPH, Zlatko Sisic, MD, MBA, Suzanne Wait, PhD and Henrik B. Boysen.The Humanistic burden of hereditary angioedema: Results from the Burden of Illness Study in Europe. . Allergy and Asthma Proceedings.




