Redacción Farmacosalud.com
Un estudio confirma el potencial de olmutinib como tratamiento para pacientes de cáncer de pulmón no microcítico con mutación T790M del EGFR y que han desarrollado resistencia al tratamiento inicial con inhibidores de la tirosina quinasa. Los resultados demuestran que más de la mitad de pacientes (54%) presenta una respuesta objetiva confirmada. En paralelo, se han conocido datos clínicos y de seguridad positivos acerca de osimertinib en pacientes con metástasis leptomeníngea (ML), una complicación del cáncer de pulmón no microcítico (CPNM) avanzado con receptor del factor de crecimiento epidérmico (EGFR) mutado (EGFRm). Entre los pacientes que recibieron osimertinib, hubo mejoría radiológica intracraneal, mejoría de la función neurológica y eliminación de las células cancerosas del líquido cefalorraquídeo en dos visitas consecutivas. Y un estudio preliminar de eficacia con KEYTRUDA® (pembrolizumab), combinado con tratamientos estándar, en pacientes sin tratamiento previo con carcinoma pulmonar no microcítico (CPNM), incluyendo quimioterapia en pacientes sin tratamiento previo, ha mostrado tasas de respuesta global (TRG) de entre un 48 y un 71%.
El potencial de olmutinib
Un estudio de fase II de la firma Boehringer Ingelheim confirma el potencial de olmutinib como tratamiento para pacientes de cáncer de pulmón no microcítico con mutación T790M del EGFR y que han desarrollado resistencia al tratamiento inicial con inhibidores de la tirosina quinasa. Estos datos se han presentado en el marco del congreso de la Asociación Americana de Oncología Médica celebrado en Chicago. Los resultados demuestran que más de la mitad de pacientes (54%) presenta una respuesta objetiva confirmada, con una mediana de la duración de 8,3 meses, según revisión independiente.[1] Además, también confirman que la mayoría de acontecimientos adversos relacionados con el tratamiento son leves o moderados.[1]
En este sentido se manifiesta el investigador coordinador, el Dr. Keunchil Park, del Servicio de Hematología y Oncología del Centro Médico Samsung, Facultad Medicina de la Universidad de Sungkyunkwan, en Corea del Sur, quien opina que “estos últimos datos corroboran la eficacia potencial de olmutinib. Estamos creando una sólida evidencia clínica y esperamos con gran interés poder analizar los resultados del ensayo pivotal fase II.” La finalidad de los inhibidores de la tirosina quinasa de tercera generación, incluido olmutinib, es proporcionar opciones de tratamiento nuevas y necesarias a pacientes que han desarrollado resistencia a los de primera y segunda generación, y actualmente se investiga su potencial como nuevas opciones de tratamiento de primera línea.
Autor/a: Pzucchel
Fuente: Wikipedia
Se analizará olmutinib en monoterapia y en combinación con otros tratamientos
Boehringer Ingelheim ha puesto en marcha el programa de ensayos ELUXA, con el fin de investigar de forma exhaustiva el potencial terapéutico de olmutinib. La compañía analizará olmutinib en monoterapia en diferentes contextos, así como en combinación con otros tratamientos contra el cáncer ya disponibles como en fase de investigación. Este mismo año se inician estudios fase III así como estudios de fase I y II en el contexto de primera y segunda línea. Olmutinib se analizará en combinación con el tratamiento de inmunoncología Keytruda®+, el TKI de segunda generación Giotrif®**, los agentes antiangiogénicos Vargatef®*** , Avastin® y el AcM anti-IGF BI 836845**** que se encuentran en fase de investigación de Boehringer Ingelheim.
Olmutinib es un TKI de tercera generación específico para la mutación del EGFR. Actualmente, se investiga para el tratamiento de pacientes con cáncer de pulmón no microcítico avanzado y metastásico con mutación del EGFR, y con resistencia mediada por T790M al tratamiento inicial con TKI-EGFR.
Osimertinib mejora la función neurológica
Por su parte, la compañía biofarmacéutica AstraZeneca ha anunciado datos clínicos y de seguridad de osimertinib en pacientes con metástasis leptomeníngea (ML), una complicación del cáncer de pulmón no microcítico (CPNM) avanzado con receptor del factor de crecimiento epidérmico (EGFR) mutado (EGFRm)[2] en la que las células cancerosas invaden el líquido cefalorraquídeo (LCR). La ML es una enfermedad muy grave que se asocia al cáncer de pulmón avanzado. Los resultados actualizados del ensayo Fase I BLOOM, presentados en el Congreso Anual de la Sociedad Americana de Oncología Clínica (ASCO, por sus siglas en inglés), ilustran que, independientemente del estado de la mutación T790M en los pacientes, osimertinib provocó un cambio en la intensidad de las señales de las resonancias magnéticas (RMN) indicativo de una reducción de las lesiones del sistema nervioso central (SNC)[2].
Los datos de 21 pacientes que recibieron osimertinib (160 mg una vez al día) demostraron mejoría radiológica intracraneal (7 pacientes), mejoría de la función neurológica (5 pacientes) y eliminación de las células cancerosas del líquido cefalorraquídeo en dos visitas consecutivas (2 pacientes)[2]. Ninguno de los 21 pacientes tratados con osimertinib recibió radioterapia ni quimioterapia intratecal concomitantes. Quince de los pacientes seguían en tratamiento en el corte de datos del 10 de marzo de 2016, de los que 7 llevaban en tratamiento más de 9 meses[2]. Además, los datos adicionales del estudio BLOOM demostraron, que osimertinib atraviesa la barrera hematoencefálica. En 6 de 9 pacientes se observó una reducción superior al 50% del nivel de mutación en EGFR en el líquido cefalorraquídeo hasta el día 1 del ciclo 9 del tratamiento, y en 5 de ellos la reducción fue sostenida. Estos resultados respaldan los datos preclínicos publicados anteriormente que demostraron que osimertinib atravesaba la barrera hematoencefálica[3].

Autor/a: Piotr Siedlecki
Fuente: www.publicdomainpictures.net
El Dr. James CH Yang, del Hospital Universitario Nacional de Taiwán y del Centro Oncológico de la Universidad Nacional de Taiwán de Taipei, declara: “La metástasis leptomeníngea conlleva un pronóstico devastador, por lo que el perfil de seguridad, tolerabilidad y actividad observado con osimertinib es alentador. En el estudio BLOOM observamos una reducción de las lesiones del sistema nervioso central de los pacientes con metástasis leptomeníngea, con mejoría neurológica concomitante. Los resultados se añaden a los datos previos de osimertinib en estudios preclínicos y clínicos y aportan evidencias sobre el potencial de osimertinib en los pacientes difíciles de tratar con metástasis en el sistema nervioso central”.
Metástasis leptomeníngea: por ahora tratada con quimio y radioterapia o inhibidores ITK
En la metástasis leptomeníngea, las células cancerosas invaden las membranas que recubren el cerebro y la médula espinal. La enfermedad se trata actualmente con quimioterapia sistémica o intratecal, radioterapia a todo el cerebro o inhibidores de la actividad de tirosina quinasa (ITK) del EGFR, con una mediana de supervivencia global de 4,5-11 meses[4,5]. Sin embargo, el hecho de que la mayoría de los ITK del EGFR apenas puedan atravesar la barrera hematoencefálica limita su capacidad para tratar o prevenir eficazmente las metástasis cerebrales[6-8]. En un análisis retrospectivo de la práctica clínica habitual publicado recientemente sobre los pacientes con CPNM EGFRm tratados con ITK del EGFR, la supervivencia global fue de aproximadamente 30 meses[9].
Osimertinib (160 mg) se asoció a un perfil de tolerabilidad manejable durante períodos de tratamiento de hasta 11 meses. Los acontecimientos adversos más frecuentes referidos por los pacientes fueron diarrea (58% en total; 5% ≥ grado 3), náusea (48% en total; 0% ≥ grado 3) y erupción (43% en total; 0% ≥ grado 3). No se notificó ningún caso de enfermedad pulmonar intersticial, hiperglucemia ni prolongación del intervalo QT. Osimertinib ha recibido recientemente la aprobación acelerada como primer tratamiento indicado para pacientes con CPNM metastásico o localmente avanzado con la mutación EGFR T790M en la UE, EE.UU., Japón e Israel. Osimertinib también está aprobado en Corea del Sur para la misma indicación. En España este tratamiento se encuentra en fase de obtención de precio y reembolso por parte de las Autoridades Sanitarias.
Osimertinib (80 mg una vez al día en comprimidos) es el primer medicamento indicado para el tratamiento de los pacientes adultos con CPNM metastásico o localmente avanzado con la mutación T790M del EGFR. Los estudios in vitro no clínicos han demostrado que osimertinib presenta una potente actividad inhibidora de la fosforilación de EGFR mutado en las distintas líneas celulares clínicamente relevantes de CPNM con la mutación T790M y otras del EGFR con una actividad mucho menor en las líneas celulares con EGFR de tipo silvestre (sin mutaciones)[10]. Se está realizando una comparación entre osimertinib y la quimioterapia doble basada en platino en el estudio de fase III confirmatorio AURA3 en pacientes con CPNM metastásico o localmente avanzado con mutación T790M del EGFR que han sufrido progresión después del tratamiento con ITK del EGFR[11]. También se está investigando en los contextos de adyuvante y primera línea metastásico[12,13], incluso en pacientes con y sin metástasis cerebral, en la metástasis leptomeníngea[14] y en combinación con otros compuestos[15].
Eficacia de pembrolizumab
A todo esto, MSD ha anunciado los resultados de un estudio preliminar de eficacia con KEYTRUDA® (pembrolizumab), la terapia anti-PD-1 de la compañía, combinado con tratamientos estándar, uno con bevacizumab y otros sin él, en pacientes sin tratamiento previo con carcinoma pulmonar no microcítico (CPNM), incluyendo quimioterapia en pacientes sin tratamiento previo con CPNM: el estudio ha mostrado tasas de respuesta global (TRG) de entre un 48 y un 71 por ciento, según la quimioterapia empleada. Estos datos, procedentes del ensayo de fase 1/2 KEYNOTE-021, se han presentado en la 52ª Reunión anual de la Sociedad Americana de Oncología Clínica (ASCO).
Los resultados presentados en ASCO 2016 se basaron en 74 pacientes que recibieron tratamiento con KEYTRUDA y con uno de los tres diferentes regímenes de quimioterapia en la fase 1b del estudio. Los datos, que proceden de las tres cohortes y engloban a pacientes con y sin expresión del PD-L1, muestran una TRG del 57 por ciento (n=42/74, IC 95%, 45-68), incluidas una respuesta completa y 41 respuestas parciales. La mediana de la duración del seguimiento fue de 12 meses (rango <1-21). "Estos resultados son alentadores porque proporcionan evidencia inicial de que asociar quimioterapia a KEYTRUDA puede aumentar las tasas de respuesta y abrir nuevas vías de tratamiento para un rango más amplio de pacientes con carcinoma pulmonar no microcítico avanzado", comenta el Dr. Gadgeel, profesor jefe del equipo multidisciplinar de oncología torácica del Instituto Oncológico Karmanos/ Universidad Estatal de Wayne en Detroit.
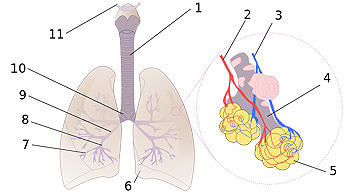
Diagrama pulmonar
1:Tráquea 2:Arteria pulmonar 3:Vena pulmonar 4:Bronquiolo terminal 5:Alvéolos 6:Corte cardíaco 7:Bronquios terciarios o segmentados 8:Bronquios secundarios o lobales 9:Bronquio principal 10:Bifurcación traquial o carina 11:Laringe
Autor/a de la imagen: Rastrojo (D•ES) - trabajo propio a partir de Image:Illu bronchi lungs.jpg
Fuente: Wikipedia
Respuestas en todos los niveles PD-L1, incluidos los tumores negativos al PD-L1
Las tasas de respuesta más elevadas se observaron en un grupo de 24 pacientes que recibieron KEYTRUDA (pembrolizumab) en combinación con carboplatino más pemetrexed (cohorte C), con una TRG del 71 por ciento (n=17/24, IC 95%, 49-87), incluida una respuesta completa y 16 respuestas parciales. En este mismo grupo, la mediana de la supervivencia libre de progresión SLP fue de 10,2 meses (IC 95%, 6,3-15,2), y la mediana de la supervivencia global (SG) no se alcanzó (IC 95%, 13,9-NR). La mediana de la duración del seguimiento fue de 16 meses (rango 4-21). En el grupo al que se le administró KEYTRUDA más carboplatino y paclitaxel (cohorte A), la TRG fue del 52 por ciento (n=13/25, IC 95%, 31-72) y todas las respuestas fueron parciales. La SLP en esta cohorte fue de 10,3 meses (IC 95%, 3,7-NR), y la SG mediana no se alcanzó (IC 95%, 11,0-NR). La duración mediana del seguimiento fue de 13 meses (rango 2-21). En la cohorte que recibió KEYTRUDA además de carboplatino, paclitaxel y bevacizumab (cohorte B), la TRG fue del 48 por ciento (n=12/25, IC 95%, 28-69) y todas las respuestas fueron parciales. La mediana de la SLP no se alcanzó (IC 95%, 4,1-NR) y la mediana de la SG, tampoco (IC 95%, NR-NR). La mediana de la duración del seguimiento fue de 9 meses (rango <1-17). Se observaron respuestas en todos los niveles de expresión del PD-L1, incluidos los pacientes con tumores negativos al PD-L1. Los niveles de PD-L1 evaluados mostraron una expresión elevada (puntuación de la proporción del tumor [TPS] mayor que o igual al 50 por ciento), cualquier expresión (TPS mayor que o igual al 1 por ciento) y expresión negativa (PD-L1 de menos del 1 por ciento).
El perfil de seguridad de KEYTRUDA (pembrolizumab) en combinación con la quimioterapia en este estudio coincide con el observado anteriormente. En la cohorte C se produjo un acontecimiento de toxicidad limitante de la dosis que ocasionó la interrupción del tratamiento (necrólisis epidérmica tóxica grado 3). Se suspendió la administración a tres pacientes de la cohorte B a causa de acontecimientos adversos relacionados con el tratamiento (colitis autoinmunitaria, hipersensibilidad farmacológica y neumonitis de grado 3). Ningún paciente de la cohorte A se vio obligado a interrumpir la administración a causa de acontecimientos adversos relacionados con el tratamiento.
Se dieron acontecimientos adversos relacionados con el tratamiento de grado 3-5 en el 56, el 71 y el 67 por ciento de los pacientes de las cohortes A, B y C, respectivamente. En la cohorte B, los acontecimientos adversos de grado 3-4 más frecuentes fueron hipersensibilidad farmacológica (8%), neutropenia febril (8%), neutropenia (8%), disminución del recuento de glóbulos blancos (8%), neumonía (8%) y embolia pulmonar (8%). Se observaron acontecimientos adversos con mediación inmunitaria, principalmente de grado 1-2, en todas las cohortes. Los acontecimientos adversos Grado 3 relacionados con el tratamiento con mediación inmunitaria fueron colitis, (4% cohorte C), exantema papular (4% cohorte A), pancreatitis (4% cohorte B), neumonitis (4% cohorte B) y necrólisis epidérmica tóxica (4% cohorte C). No hubo muertes relacionadas con el tratamiento en ninguna de las cohortes; hubo una muerte en la cohorte B (derrame pericárdico de grado 5) que no estaba relacionada con el tratamiento.
Asimismo, MSD ha anunciado que el ensayo KEYNOTE-024, en el que se investiga el uso de KEYTRUDA® (pembrolizumab) en los pacientes con carcinoma pulmonar no microcítico (CPNM) avanzado sin tratamiento previo y cuyos tumores expresaron niveles elevados de PD-L1 (≥50), ha alcanzado su objetivo primario. En este ensayo, KEYTRUDA fue superior a la quimioterapia tanto en el objetivo primario de supervivencia libre de progresión (SLP) como en el objetivo secundario de supervivencia global (SG). Sobre la base de estos resultados, un comité de seguimiento de datos (DMC) independiente ha recomendado que se detenga el estudio y que se ofrezca a los pacientes del KEYNOTE-024 que reciben quimioterapia la oportunidad de recibir KEYTRUDA.
Autor: GrahamColm
Fuente: Wikipedia / Wikimedia Commons
La biopsia líquida, una prueba no invasiva que facilita la selección del tratamiento
Gracias a los avances que se van produciendo, año tras año, tanto en el diagnóstico como en el tratamiento de los tumores, cada vez se cuenta con más herramientas que ayudan a definir las características propias de cada tumor y qué tratamiento es el más adecuado para cada paciente. Este es el caso del cáncer de pulmón no microcítico (CPNM), que representa cerca del 85% de todos los casos de tumor de pulmón, y para el que ya está disponible en España una prueba para determinar la mutación EGFR presente en aproximadamente el 10% de los pacientes con CPNM, gracias a la biopsia líquida (o determinación en sangre), han apuntado desde la firma Roche y la Sociedad Española de Anatomía Patológica (SEAP).
Se estima que en España al 70% de los pacientes con cáncer de pulmón se les diagnostica en fase avanzada y todos ellos son candidatos a someterse a una biopsia para saber si tienen algún tipo de mutación, y a partir de ahí elegir un tratamiento dirigido a esa mutación. La determinación de EGFR en plasma consiste en un sencillo análisis a través del cual se extrae una pequeña muestra de sangre del enfermo para analizarla molecularmente, lo que sirve para determinar si el gen EGFR está o no mutado. En definitiva, la determinación del perfil mutación de EGFR en sangre (también llamada biopsia líquida) es una prueba no invasiva que facilita la selección del tratamiento más beneficioso para el enfermo.
La secuenciación masiva, muy útil en cáncer de pulmón
Obtener información muy detallada de varios genes de forma simultánea ya es posible gracias a la tecnología de secuenciación masiva NGS (Next Generation Sequencing, por sus siglas en inglés). Este avance es especialmente relevante para los pacientes que presentan un cáncer de pulmón porque conocer cuál es exactamente la alteración molecular o la traslocación implicada permite el tratamiento con una terapia dirigida, informa la firma Pfizer.
Aunque esta tecnología todavía no está implementada en España de forma sistemática para uso clínico, sí existen profesionales de referencia en nuestro país que recientemente han formado a patólogos y biólogos moleculares europeos en Madrid acerca de las posibilidades de la NGS, compartiendo su experiencia en la aplicación clínica de esta técnica. En concreto, una de las principales ventajas de la tecnología NGS es que permite estudiar hasta miles de alteraciones moleculares en cientos de genes a través de un solo proceso. Dichas alteraciones pueden ser tanto mutaciones como amplificaciones o traslocaciones. Esta tecnología puede emplearse en cualquier tipo de tumor pero su utilización es especialmente relevante en el cáncer de pulmón debido a la elevada probabilidad de encontrar una diana terapéutica.
Referencias
1. Park K. et al. BI 1482694 (HM61713), an EGFR mutant-specific inhibitor, in T790M+ NSCLC: efficacy and safety at the RP2D. Abstract #9055. Póster presentado el sábado 4 de junio de 2016. Congreso de la ASCO de 2016.
2. Yang JCH, et al. Osimertinib activity in patients (pts) with leptomeningeal (LM) disease from non-small cell lung cancer (NSCLC): updated results from BLOOM, a Phase I study. Abstract 9002 [Oral Presentation]. Presented at the annual meeting of the American Society of Clinical Oncology, 3-7 June 2016, Chicago, USA
3. Ballard P, et al. Preclinical activity of AZD9291 in EGFR-mutant NSCLC brain metastases. Presented at the World Congress on Lung Cancer, 6-9 September 2015. Denver, Colorado, USA.
4. Liao BC et al. Epidermal Growth Factor Receptor Tyrosine Kinase Inhibitors for Non-Small-Cell Lung Cancer Patients with Leptomeningeal Carcinomatosis. J Thorac Oncol. 2015 Dec;10(12):1754-61
5. Umemura S et al. Clinical outcome in patients with leptomeningeal metastasis from non-small cell lung cancer: Okayama Lung Cancer Study Group. Lung Cancer. 2012 Jul;77(1):134-9.
6. European Medicines Agency CHMP assessment report for Giotrif. 2013
7. De Vries NA et al. Restricted brain penetration of the tyrosine kinase inhibitor erlotinib due to the drug transporters P-gp and BCRP. Invest New Drugs. 2012 Apr;30(2):443-9.
8. Zhao J et al. Cerebrospinal fluid concentrations of gefitinib in patients with lung adenocarcinoma. Clin Lung Cancer. 2013 Mar;14(2):188-93.
9. Inoue A et al. Characteristics and overall survival of EGFR mutation-positive non-small cell lung cancer treated with EGFR tyrosine kinase inhibitors: a retrospective analysis for 1660 Japanese patients. Jpn J Clin Oncol. 2016 Mar 13. pii: hyw014. [Epub ahead of print]
10. Cross DAE, et al. AZD9291, an Irreversible EGFR TKI, Overcomes T790M-Mediated Resistance to EGFR Inhibitors in Lung Cancer. Cancer Discov. 2014;4:1046-61
11. National Institutes of Health. AZD9291 Versus Platinum-Based Doublet-Chemotherapy in Locally Advanced or Metastatic Non-Small Cell Lung Cancer (AURA3). Available at: https://clinicaltrials.gov/ct2/show/NCT02151981?term=AURA3&rank=1. Accessed May 2016.
12. National Institutes of Health. AZD9291 Versus Placebo in Patients With Stage IB-IIIA Non-small Cell Lung Carcinoma, Following Complete Tumour Resection With or Without Adjuvant Chemotherapy (ADAURA). Available at: https://www.clinicaltrials.gov/ct2/show/NCT02511106?term=AZD9291+Versus+Placebo+in+Patients&rank=1. Accessed May 2016.
13. National Institutes of Health. AZD9291 Versus Gefitinib or Erlotinib in Patients With Locally Advanced or Metastatic Non-small Cell Lung Cancer (FLAURA). Available at https://clinicaltrials.gov/ct2/show/NCT02296125?term=FLAURA&rank=1. Accessed May 2016.
14. National Institutes of Health. Oral Epidermal Growth Factor Receptor Tyrosine Kinase Inhibitors, AZD3759 or AZD9291, in Patients Who Have Advanced Non-Small Cell Lung Cancer (BLOOM). Available at: https://clinicaltrials.gov/ct2/show/NCT02228369?term=AZD9291+brain+met&rank=1. Accessed May 2016.
15. National Institutes of Health. AZD9291 in Combination With Ascending Doses of Novel Therapeutics. Available at: https://clinicaltrials.gov/ct2/show/NCT02143466?term=azd9291&rank=1. Accessed May 2016.
……………………………………………….........................
*Olmutinib (BI 1482694 / HM61713) está autorizado en Corea del Sur para el tratamiento del cáncer de pulmón con mutación T790M del EGFR. No se ha autorizado en otras indicaciones o países. Los ensayos se encuentran en curso y se presentarán a las autoridades reguladoras en cuanto se tengan resultados
**Afatinib (Giotrif®) está autorizado en España para pacientes el tratamiento en primera línea del cáncer de pulmón no microcítico avanzado con mutaciones frecuentes del EGFR y para el tratamiento del cáncer de pulmón no microcítico (CPNM) localmente avanzado o metastásico de histología escamosa que progrese durante o tras quimioterapia basada en platino
***Nintedanib (Vargatef®) está autorizado en España para el tratamiento en combinación con docetaxel de pacientes adultos con CPNM localmente avanzado, metastásico o localmente recurrente, del tipo histológico adenocarcinoma, después de quimioterapia de primera línea.
****BI 836845 no está autorizado, y su eficacia y seguridad aún no se han determinado plenamente.
+ KEYTRUDA® es un nombre comercial registrado de Merck Sharp & Dohme Corp., una filial de Merck & Co., Inc.




