Redacción Farmacosalud.com
La inmunoterapia con Atezolizumab es una opción eficaz para el tratamiento del carcinoma urotelial localmente avanzado o metastásico, un tipo histológico que representa el 90% de todos los tumores de vejiga y que lleva casi tres décadas sin incorporar avances destacables. La compañía Roche ha anunciado que en un estudio fase II, IMvigor210, Atezolizumab redujo el tamaño los tumores (tasa de respuesta objetiva, TRO) en un 24% (n=28) en pacientes con carcinoma urotelial localmente avanzado o metastásico (mUC) que no habían recibido tratamiento previo (primera línea) y que no fueron elegibles para la quimioterapia basada en cisplatino.
De las personas que respondieron, el 75% (n=21) siguió respondiendo al tratamiento y la duración media de la respuesta (mDOR) no se había alcanzado en el momento del análisis. El 7% (n=8) de los pacientes participantes en el estudio lograron una respuesta completa (RC). La mediana de supervivencia global (SG) fue de 14,8 meses. El perfil de seguridad de Atezolizumab fue consistente con el observado en los análisis previos del estudio. Así lo ha demostrado el estudio fase II IMvigor 210, cuyos resultados se han presentado en la 52 Reunión de la Asociación Americana de Oncología Clínica (Chicago, junio 2016), con participación de siete hospitales españoles.
La inmunoterapia logra que la respuesta al tratamiento se mantenga más tiempo
Estos resultados representan una esperanza para los pacientes con la enfermedad avanzada cuando las opciones eficaces de tratamiento son limitadas. Como indica el doctor José Luis Pérez Gracia, oncólogo de la Clínica Universitaria de Navarra (Pamplona) y uno de los especialistas participantes en el estudio, “los datos son muy positivos. En primer lugar, porque dan respuesta satisfactoria a la prueba de concepto planteada: demuestra que inducir al sistema inmunitario a combatir este tumor es una posibilidad válida en el manejo de una enfermedad que en su fase avanzada está muy necesitada de terapias activas”. “Además”, añade este experto, “constatamos que la inmunoterapia logra un hito: que la respuesta al tratamiento se mantenga durante muchos más meses que la quimioterapia y que lo haga de forma menos tóxica. Comprobar que podemos estar pasando de no poder ofrecer algo realmente eficaz a lo contrario nos anima a seguir trabajando en beneficio de los pacientes que aún no cuentan con una terapia que funcione”.
Fuente: Roche / Planner Media
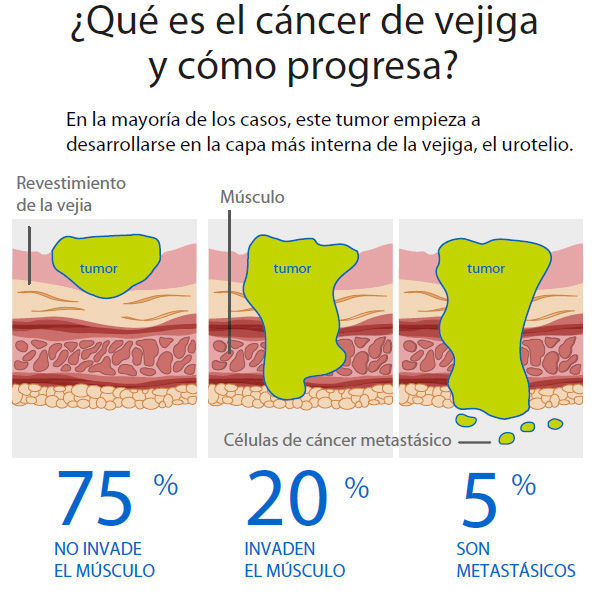
En España se diagnostican unos 14.000 nuevos casos al año de cáncer de vejiga. El doctor Pérez Gracia aclara que es un tumor con buen pronóstico en fases iniciales pero muy recurrente y de difícil control cuando se extiende más allá de la vejiga. “En estos casos las líneas de quimioterapia disponible ofrecen resultados de duración muy limitada. Ahora con la inmunoterapia no es que respondan muchos más pacientes que con la quimioterapia: la diferencia estriba en que la duración de la mayoría de esas respuestas, un 85%-95% aproximadamente, son muy superiores. Suponen tener la enfermedad bajo control, que deja de crecer y de dar problemas al paciente con el consiguiente beneficio sobre la calidad de vida”, explica.
Acerca del estudio IMvigor 210
IMvigor210 es un estudio abierto fase II, multicéntrico, de un solo brazo que evaluó la seguridad y eficacia de Atezolizumab en pacientes con cáncer urotelial localmente avanzado o metastásico, independientemente del nivel de expresión de PD-L1. Los pacientes fueron incluidos en una de las dos cohortes. Cohorte 1 incluyó a pacientes que no habían recibido tratamientos previos para su cáncer urotelial localmente avanzado o metastásico y que no se consideraron candidatos para la primera línea de quimioterapia basada en cisplatino. La cohorte 2 incluyó pacientes cuya enfermedad había progresado durante o después del tratamiento previo con un régimen de quimioterapia basada en platino (de segunda línea o posterior).
Los datos actualizados de la cohorte 1 del ensayo IMvigor 210 (primera línea, previamente no tratados) mostraron:
-Una TRC del 24% (n=28) (95% CI; 16, 32)
-El 7% (n=8) de los pacientes en el ensayo alcanzó una respuesta completa (RC)
-La mediana de la duración de la respuesta no se alcanzó tras 14,4 meses de seguimiento; el 75% de las respuestas (n=21) continuaban en el momento del análisis.
-La mediana de SG fue de 14,8 meses (95% CI; 10.1, no estimable), y a los doce meses la SG era del 57%.
Fuente: Roche / Planner Media
El 15% por ciento de los pacientes que recibió Atezolizumab experimentó efectos adversos de grado 3-4 relacionados con el tratamiento. El 6% de los pacientes experimentaron un efecto adverso que les hizo interrumpir el tratamiento y el 35% tuvo un efecto adverso que le llevó a la interrupción de la dosis. Los efectos adversos relacionados con el tratamiento (todos los grados) ocurrieron en el 66% de los pacientes. Se produjo un efecto adverso de grado 5 (sepsis o infección de la sangre). El 6% de los pacientes sufrió efectos adversos de grado 3-4 inmunomediados.
Los datos actualizados del cohorte 2 del estudio IMvigor 210, el ensayo por el que Atezolizumab obtuvo la aprobación acelerada de la FDA para los pacientes con cáncer urotelial localmente avanzado o metastásico que habían progresado a la enfermedad durante o después de una quimioterapia basada en platinos, o cuya enfermedad había empeorado durante los 12 meses en los que recibió quimioterapia basada en platinos antes de cirugía (neoadyuvancia) o después (adyuvancia), han sido presentados por Robert Dreicer, director asociado de Investigación Clinica, Hematología y Oncología de la Escuela de Medicina de la Universidad de Virginia en Charlottesville.
Datos actualizados del cohorte 2 del estudio IMvigor210 (previamente tratados con quimioterapia basada en platinos) mostraron:
-Una tasa de respuesta objetiva fue del 16% (n=49) (95% CI; 12, 20)
-El 7% (n=21) de los pacientes alcanzaron un RC
-La mediana de la DRO no se alcanzó tras un seguimiento de 17,5 meses, el 71% de las respuestas continuaban en el momento del análisis.
-La mediana de SG fue de 7.9 meses (95%, CI, 7, 9), y a los 12 meses la SG era del 37%.
El 17% de los pacientes que recibió Atezolizumab experimentó efectos adversos de grado 3 y 4 relacionados con el tratamiento. El 3% de los pacientes sufrió un evento adverso que condujo a la interrupción del tratamiento, y el 31% tuvo un evento adverso que llevó a la interrupción de la dosis. Los eventos adversos relacionados con el tratamiento (de todos los grados) ocurrieron en el 70% de los pacientes. Se produjeron tres eventos adversos de grado 5: obstrucción intestinal, sepsis (infección de la sangre) y hemorragia cerebral.
Sin avances importantes en más de 30 años en cáncer urotelial metastásico
La aprobación acelerada concedida por la FDA a Atezolizumab (Tecentriq®) es para pacientes con carcinoma urotelial localmente avanzado o metastásico que hayan sufrido una progresión de la enfermedad durante o después de una quimioterapia basada en platinos o cuya enfermedad haya recaído en los 12 meses siguientes a una quimioterapia con platinos previa a la cirugía (tratamiento neoadyuvante) o posterior a ella (tratamiento adyuvante). Roche evalúa actualmente esta inmunoterapia en el estudio fase III IMvigor 211 comparándolo con quimioterapia en pacientes cuyo tumor de vejiga haya progresado tras recibir al menos una pauta de quimioterapia basada en platinos.
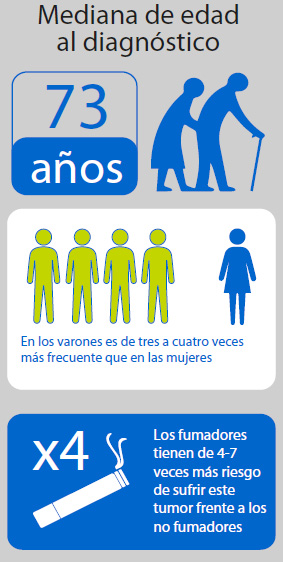
El cáncer urotelial metastásico tiene mal pronóstico y cuenta con pocas opciones de tratamiento. Es una enfermedad en la que no se han producido avances importantes en más de 30 años. El urotelial es el noveno tipo de cáncer más frecuente en todo el mundo: en 2012 se diagnosticaron 430.000 nuevos casos, y anualmente provoca unas 145.000 muertes. Los varones tienen una probabilidad tres veces mayor de padecerlo, y la enfermedad es tres veces más común en los países desarrollados.
Es un anticuerpo monoclonal diseñado para actuar sobre una proteína denominada PD-L1 expresada en las células tumorales y en las del sistema inmune que se infiltran en el tumor. Su objetivo es evitar que se unan a PD-1 y B7.1 sobre la superficie de los linfocitos T. Inhibiendo PD-L1, Atezolizumab puede permitir la activación de los linfocitos T restaurando de ese modo su capacidad para detectar y atacar de forma eficaz a las células tumorales.

Fuente: Roche / Planner Media
Durvalumab en monoterapia, eficaz en carcinoma urotelial de vejiga
Por su parte, la compañía biofarmacéutica AstraZeneca y su división mundial de investigación y desarrollo de biológicos, MedImmune, han anunciado datos sobre la eficacia y seguridad de durvalumab, un anticuerpo monoclonal humano en investigación dirigido contra el ligando-1 de la molécula de muerte celular programada (PD-L1), en pacientes con carcinoma urotelial de vejiga avanzado[1]. Los resultados preliminares del ensayo Fase I/II, presentados en el Congreso Anual de la Sociedad Americana de Oncología Médica (ASCO, por sus siglas en inglés), demuestran una tasa de respuesta objetiva (TRO) del 31% en todos los pacientes evaluables [intervalo de confianza (IC) de 95%: 18%-47%] y del 46% (IC de 95%: 28%-66%) en pacientes con tumores que expresan un nivel alto de PD-L1[1] (un alto nivel de PD-L1 se define como una tinción de PD-L1 del 25% o más de las células tumorales (CT) o de las células inmunitarias (CI) evaluada mediante el ensayo diagnóstico Ventana SP263[1]).
La tasa de control de la enfermedad (TCE), que se define como respuesta confirmada completa o parcial o enfermedad estable durante 12 o más semanas, fue del 48 % (IC de 95%: 32%-64%) en todos los pacientes evaluables y del 57% (IC de 95%: 37%-76%) en los pacientes con tumores que expresan un nivel alto de PD-L1[1]. Todavía no se ha alcanzado la mediana de duración de la respuesta[1].
Se estudia el uso de durvalumab en monoterapia o con tremelimumab en varios tumores
Durvalumab 10 mg/kg fue administrado cada dos semanas por vía intravenosa hasta un máximo de 12 meses y demostró un perfil de seguridad manejable en todos los pacientes (n = 61)[1]. Los acontecimientos adversos más frecuentes notificados en el 5% o más de los pacientes fueron todos de grado 1 o 2: fatiga (13%), diarrea (10%), falta de apetito (8%), artralgia (7%), astenia (7%), náuseas (7%) y pirexia (7%)[1]. Tres pacientes experimentaron acontecimientos adversos relacionados con el tratamiento de grado 3 (1 daño renal agudo, 1 reacción relacionada con la infusión y 1 exacerbación del tumor)[1]. El Dr. Christophe Massard, director de Ensayos Clínicos en Primeras Fases en el Institut Gustave Roussy, Villejuif (Francia), declara: “Estos datos preliminares positivos siguen respaldando la eficacia clínica y la seguridad de durvalumab para el tratamiento del carcinoma de vejiga, y lo confirman como posible terapia innovadora para una población de pacientes con una gran necesidad no cubierta.”
El pasado mes de febrero durvalumab obtuvo la designación de ‘terapia innovadora’ (breakthrough therapy) concedida por Agencia Americana del Medicamento (FDA, por sus siglas en inglés) como posible tratamiento para pacientes con carcinoma uroterial de vejiga metastásico o inoperable positivo para PD-L1[2]. Durvalumab también se está estudiando en monoterapia o combinado con tremelimumab, en cáncer de pulmón no microcítico (CPNM), y en cáncer de cabeza y cuello, vejiga, gástrico, pancreático, carcinoma hepatocelular (CHC) y hematológico y es uno de los pilares del programa de inmunooncología en últimas fases de desarrollo de AstraZeneca, en el que participan más de 7.000 pacientes en 19 ensayos clínicos con distintos tipos de tumores[3,4].
Referencias
1. Massard C et al. Safety and Efficacy of Durvalumab (MEDI4736), an Anti-PD-L1 Immune Checkpoint Inhibitor, in Patients with Advanced Urothelial Bladder Cancer. JCO Accepted Manuscript. To be published June 2016.
2. AstraZeneca. Durvalumab granted Breakthrough Therapy Designation by US FDA for treatment of patients with PD-L1 positive urothelial bladder cancer. 17 February 2016. Available at https://www.astrazeneca.com/media-centre/press-releases/2016/Durvalumab-granted-Breakthrough-Therapy-designation-by-US-FDA-for-treatment-of-patients-with-PD-L1-positive-urothelial-bladder-cancer-17022016.html. Accessed May 2016.
3. AstraZeneca. Data on File. Q1 2016 Immuno-oncology Update: Clinical Trials Appendix. 2016
4. AstraZeneca. Durvalumab ATLANTIC trial supports clinical activity and AstraZeneca’s overall immuno-oncology strategy. 18 December 2015. Available at https://www.astrazeneca.com/media-centre/press-releases/2015/Durvalumab-ATLANTIC-trial-supports-clinical-activity-and-AstraZenecas-overall-immuno-oncology-strategy.html. Accessed May 2016.




