Redacción Farmacosalud.com
La compañía Novartis ha presentado los resultados de un estudio de Fase III que demuestran que Votubia®* (everolimus), cuando es usado como un tratamiento coadyuvante en pacientes con complejo de esclerosis tuberosa (CET), y concretamente a dosis más altas, reduce significativamente las crisis convulsivas al tratamiento en comparación con placebo[1]. Los pacientes de todos los grupos de tratamiento también recibieron de uno a tres fármacos antiepilépticos (FAEs)[1]. Los datos del estudio EXIST-3 (EXamining everolimus In a Study of TSC), han sido presentados en el congreso de la Asociación Europea de Neurología en Copenhague. El CET es un trastorno genético raro con una prevalencia estimada en Europa de 32.000 afectados[2]. Aproximadamente el 85% de los pacientes con CET sufren epilepsia en algún momento de sus vidas[3], y los pacientes que no logran controlar las convulsiones pueden experimentar consecuencias potencialmente graves, como problemas neuropsicológicos, cognitivos, sociales o de aprendizaje.
Everolimus es la única opción no quirúrgica aprobada e indicada para el tratamiento de tumores cerebrales y renales no cancerosos en ciertos pacientes con CET en Europa[4,5]. Los resultados del estudio EXIST-3 muestran que everolimus es la primera terapia coadyuvante que ha logrado de forma clinicamente significativa controlar las crisis convulsivas en los pacientes con CET[1]. Estos datos se suman a los hallazgos previos de los estudios con everolimus en CET, que sugieren que es un tratamiento eficaz para la enfermedad subyacente, y no está simplemente dirigido a los síntomas[6].

Autor/a: Bennington Purcell
Fuente: Flickr / Creative Commons
El tratamiento, con potencial para ser modificador de la enfermedad
"La epilepsia es uno de los aspectos más angustiantes del CET para muchos pacientes y sus familias, con un enorme impacto en la calidad de vida", explicó el Dr. David Franz, investigador principal del ensayo EXIST-3. "Los resultados de nuestro ensayo han sido muy alentadores y han demostrado que Votubia es eficaz en la reducción de las crisis epilépticas, tanto en términos de frecuencia como de intensidad. Este tratamiento tiene el potencial de ser modificador de la enfermedad y una terapia que mejora la calidad de vida de los pacientes con CET, abordando una necesidad médica no cubierta".
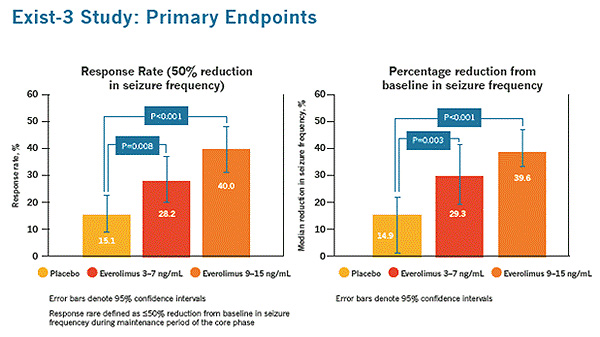
En el estudio, 366 pacientes con CET y crisis convulsivas al tratamiento fueron aleatorizados para recibir determinadas concentraciones valle de everolimus tituladas entre un rango de Exposición baja (EB; 3-7 ng / ml; n = 117) o Exposición alta (EA, 9-15 ng / mL; n = 130) o placebo (n = 119). Los resultados mostraron que la tasa de respuesta de las crisis convulsivas (definida como una reducción del 50% en la frecuencia de crisis) mejoró con everolimus en comparación con placebo (28,2% / 40,0% vs. 15,1%). Los resultados también demostraron que everolimus tanto en el rango de Exposición baja como en el de Exposición alta reduce la frecuencia de las convulsiones en comparación con el placebo (29,3% / 39,6% vs. 14,9%).
Los acontecimientos adversos más frecuentes reportados con everolimus EB/EA frente a placebo incluyeron estomatitis, úlceras bucales y diarrea.
Detalles del estudio EXIST-3
EXIST-3 es un estudio de Fase III, doble ciego, aleatorizado, controlado con placebo, de tres brazos de tratamiento, sobre la eficacia y la seguridad de dos rangos de exposición alta y baja de concentraciones valle de everolimus como terapia coadyuvante en pacientes con CET que presentan crisis convulsivas resistentes al tratamiento, definidas como crisis convulsivas persistentes a pesar del uso de dos FAEs. El estudio reclutó a hombres y mujeres (edades entre 2,2-56,3 años) con CET clínicamente definido, que estuvieran en dosis estables de entre uno a tres FAEs durante como mínimo cuatro semanas antes y durante un periodo de evaluación previo a la aleatorización de dos meses[1].
El objetivo primario era evaluar la eficacia de everolimus como tratamiento coadyuvante, comparado con placebo en la reducción de las crisis convulsivas en pacientes con CET que estén recibiendo entre uno y tres FAEs. Los objetivos secundarios incluyen el porcentaje de pacientes con crisis convulsivas durante el período de mantenimiento y el cambio en la frecuencia de las crisis convulsivas.
Los acontecimientos adversos (AA) más frecuentes ≥10% en el grupo de everolimus EB/EA frente a placebo incluyen estomatitis (28,2%/30,8% vs 3,4%), úlceras bucales (23,9%/21,5% vs 4,2%), diarrea (17,1%/21,5% vs 5,0%), nasofaringitis (13,7%/16,2% vs 16,0%), infección del tracto respiratorio superior (12,8%/15,4% vs 12,6%), úlcera aftosa (4,3%/14,6% vs 1,7%), pirexia (fiebre) (19,7%/13,8% vs 5,0%), vómitos (12,0%/10,0% vs 9,2%), tos (11,1%/10,0% vs 3,4%) y erupciones cutáneas (6,0%/10,0% vs 2,5%)[1].
Fuente: Novartis
En el estudio, 366 pacientes con CET y crisis convulsivas resistentes al tratamiento fueron aleatorizaros para recibir determinadas concentraciones valle de everolimus tituladas entre un rango de Exposición baja (EB; 3-7 ng /ml; n = 117) o Exposición alta (EA, 9-15 ng / mL; n=130) o placebo (n=119). La reducción en porcentaje de la frecuencia de crisis convulsivas de inicio fue significativamente mayor entre los pacientes aleatorizados a everolimus EB (29,3%, P = 0,003) y EA (39,6%, p <0,001) frente al placebo (14,9%). La tasa de respuesta de las crisis convulsivas (reducción ≥50%) también fue significativamente mayor con everolimus EB (28,2%, P = 0,008) y EA (40,0%, p <0,001) vs placebo (15,1%). Los acontecimientos adversos (AA) más frecuentes (≥20%) reportados con everolimus EB/EA frente a placebo incluyeron estomatitis (28,2%/30,8% vs 3,4%), ulceras bucales (23,9%/21,5% vs 4,2%) y diarrea (17,1%/21,5% vs 5,0%). Los AA graves reportados fueron del 13,7%/13,8% frente a 2,5%.
El CET puede provocar tumores no cancerosos en órganos vitales
El complejo de esclerosis tuberosa (CET) puede provocar tumores no cancerosos en órganos vitales como cerebro, riñones, corazón, pulmones y piel, así como trastornos relacionados como epilepsia, autismo, disfunción cognitiva, problemas de conducta y trastornos psiquiátricos. Muchas personas con CET muestran síntomas de la enfermedad en su primer año de vida. Sin embargo, dado que las manifestaciones varían de persona a persona y pueden tardar años en desarrollarse, muchos niños no son diagnosticados hasta etapas tardías de su vida, a menudo cuando aparecen las crisis convulsivas, lesiones cutáneas u otros síntomas significativos, como el retraso en el desarrollo. Al ser una enfermedad crónica, las últimas guías clínicas de diagnóstico realizadas por los expertos en 2012 recomiendan la monitorización de los pacientes con un médico especialista con el trastorno capaz de identificar el crecimiento tumoral o nuevos síntomas de manera precoz[7,8].
Everolimus ha sido aprobado en la Unión Europea (UE), como Votubia® para tratar a pacientes adultos con angiomiolipoma renal asociado con el complejo de esclerosis tuberosa (CET) que presentan riesgo de complicaciones (basado en factores como el tamaño del tumor, o la presencia de aneurisma o la presencia de tumores múltiples o bilaterales) pero que no requieren cirugía inmediata. La evidencia se basa en el análisis del cambio del volumen del angiomiolipoma. Votubia® también está indicado en la UE para tratar a pacientes con astrocitoma subependimario de células gigantes (SEGA) asociado al CET que requieren intervención terapéutica pero no son susceptibles a cirugía. La evidencia está basada en el análisis de cambios en el volumen del SEGA. No se ha demostrado un beneficio clínico adicional, como la mejora de los síntomas relacionado con la enfermedad. En Estados Unidos (EE.UU.) everolimus ha sido aprobado como Afinitor® para tratar a pacientes adultos con angiomiolipoma renal y CET que no necesiten cirugía inmediata. Los comprimidos de Afinitor y Afinitor Disperz® también están indicados en EE.UU. en pacientes pediátricos y adultos con CET para tratar SEGA inresecables que requieren intervención terapéutica.
Autor/a: Виталий Смолыгин
Fuente: www.publicdomainpictures.net
Además, everolimus se ha aprobado en 99 países, como EE.UU. y la UE, para tratar tumores neuroendocrinos (TNE) en progresión progresivos localmente avanzados, metastásicos o irresecables de origen pancreático y en EE.UU. en pacientes adultos con TNE en progresión, bien diferenciados y no funcionantes de origen gastrointestinal (GI) o pulmonar irresecables, localmente avanzados o metastásicos. También se ha aprobado en >120 países, como EE.UU. y la UE, para carcinoma de células renales avanzado tras la progresión a terapia dirigida con factor crecimiento endotelial vascular (VEGF) (en EE.UU., tras recibir concretamente sunitinib y sorafenib). Afinitor también se ha aprobado en 102 países, incluídos EE.UU. y la UE para cáncer de mama avanzado HR+/HER2- combinado con exemestano, tras recibir terapia endocrina.
Everolimus de Novartis, está disponible bajo el nombre comercial de Afinitor®, Certican® y Zortress® para su uso en oncología y en poblaciones de pacientes trasplantados y con licencia exclusiva a Abbott y una sublicencia a Boston Scientific para su uso en stents liberadores de fármacos. Las indicaciones pueden variar de país a país y no todas están disponibles en cada país. El perfil de seguridad y eficacia de everolimus no ha sido todavía establecido en indicaciones no aprobadas. Debido a la incertidumbre de los ensayos clínicos, no hay garantía de que everolimus se comercialice para indicaciones adicionales en cualquier parte del mundo. Everolimus actúa mediante la inhibición de la diana de la rapamicina en mamíferos (mTOR), una proteína que regula múltiples funciones celulares. El CET está causado por mutaciones en los genes TSC1 o TSC2, lo que ocasiona unahiperactivadad de la vía de mTOR que puede conducir a un aumento del crecimiento y la proliferación celular, hiperexcitabilidad neuronal, anormalías en la arquitectura cortical y en las propiedades de la red y disfunción en la plasticidad sináptica[7,9]. El estudio preciclinico sugiere que la hiperactivadad de mTOR puede afectar a varios mecanismos de epileptogénesis, el proceso gradual por el que el cerebro desarrolla epilepsia[10].
Información de seguridad importante
Afinitor/Votubia puede causar efectos secundarios graves incluyendo problemas pulmonares o respiratorios, infecciones (incluyendo sepsis) e insuficiencia renal, que pueden provocar la muerte. Los pacientes en tratamiento con inhibidores concomitantes de enzimas convertidoras de angiotensina (ECA) pueden sufrir un mayor riesgo de angioedema. Las úlceras bucales y llagas bucales son efectos secundarios comunes. Afinitor/Votubia puede afectar a los recuentos hemáticos, a la función renal y hepática, así como a la glucemia y a los niveles de colesterol y triglicéridos en sangre. Afinitor/Votubia podría causar daño fetal en mujeres embarazadas. Se recomienda el uso de medidas anticonceptivas eficaces en mujeres en edad fértil mientras reciben Afinitor/Votubia y hasta ocho semanas después de finalizar el tratamiento. Las mujeres en periodo de lactancia no deberían utilizar Afinitor/Votubia. El tratamiento con Afinitor/Votubia puede afectar a la fertilidad en hombres y mujeres.
Las reacciones adversas más frecuentes (incidencia ≥10%) son úlceras bucales, erupción cutánea, sensación de cansancio o debilidad, diarrea, infecciones (como infección del tracto respiratorio superior, dolor de garganta y moqueo, sinusitis, otitis media y neumonía), amenorrea, niveles altos de colesterol, náuseas, pérdida de apetito, nivel bajo de hematíes, acné, gusto anormal, desórdenes menstruales, inflamación del tejido pulmonar, inflamación de las extremidades u otras partes del cuerpo, nivel elevado de azúcar en sangre, prurito, pérdida de peso, hemorragias nasales, tos y dolor de cabeza. Las reacciones adversas al fármaco de grado 3-4 que se producen con mayor frecuencia (incidencia ≥2%) son úlceras bucales, infecciones (incluyendo la neumonía), nivel bajo de hematíes, amenorrea, nivel alto de azúcar en sangre, sensación de cansancio o debilidad, diarrea, nivel bajo de leucocitos, inflamación del tejido pulmonar y sangrado espontáneo o hematomas. Se han documentado casos de reactivación de la hepatitis B, coágulos sanguíneos en los pulmones o las piernas y neumonía por pneumocystis jirovecii (NPJ). Se observaron anomalías en pruebas hematológicas y en laboratorios de química clínica.

Equipo investigador en epilepsia (de izq. a dcha): Javier Garro, técnico coordinador de la Unidad de Ensayos Clínicos; la enfermera Guadalupe Sánchez, la Dra. Rocío Sánchez-Carpintero, la Dra. Maite Garriz y María José Yániz, enfermera
Fuente: Clínica Universidad de Navarra
5 ensayos para paliar crisis epilépticas en niños con enfermedades raras
A todo esto, especialistas en Neuropediatría de la Clínica Universidad de Navarra (Pamplona) han puesto en marcha cinco ensayos clínicos dirigidos a menores que sufren síndrome de Dravet, síndrome Lennox-Gastaut y esclerosis tuberosa “con el objetivo de frenar las fuertes crisis epilépticas que les producen estas enfermedades”, asegura la Dra. Rocío Sánchez-Carpintero, pediatra y neuróloga infantil de la Clínica.
El síndrome de Dravet es una enfermedad que provoca crisis epilépticas frecuentes (incluso de más de 30 minutos de duración), de difícil control y resistentes a los medicamentos, así como estancamiento en el desarrollo cognitivo y aparición de problemas conductuales (hiperactividad o trastornos de comunicación, entre otros). El síndrome Lennox-Gastaut es una encefalopatía epiléptica severa que puede provocar cientos de ataques epilépticos al día de muy difícil control.
Referencias
1. French, J, et al. Exposure-response analysis of adjunctive everolimus therapy in patients with refractory partial-onset seizures associated with tuberous sclerosis complex (TSC). Congress of European Academy of Neurology (EAN). Copenhagen, Denmark.
2. a. Orphanet. Available at: http://www.orpha.net/consor/cgi-bin/OC_Exp.php?Expert=805 [Accessed May 2016]
b. European Union Statistics. Available at: http://ec.europa.eu/eurostat/statistics-explained/index.php/Glossary:EU-28 [Accessed May 2016]
3. Chu-Shore C.J., et al. The natural history of epilepsy in tuberous sclerosis complex. Epilepsia. 2010: 51(7): 1236-1241.
4. Budde, K. and Gaedeke, J. Tuberous sclerosis complex-associated angiomyolipomas: focus on mTOR inhibition. American Journal of Kidney Diseases. 2012:276-283.
5. Votubia® (everolimus) European public assessment report. European Medicines Agency. April 2016. Available at http://www.ema.europa.eu/docs/en_GB/document_library/EPAR_-_Product_Information/human/002311/WC500112238.pdf [Accessed May 2016]
6. Curatolo, P. et al. Neurological and neuropsychiatric aspects of tuberous sclerosis complex. Lancet Neurology. 2015; 14: 733-45
7. National Institute of Neurological Disorders and Stroke fact sheet. 2010.
8. Northrup, H. et al. Tuberous sclerosis complex diagnostic criteria update: recommendations of the 2012 international tuberous sclerosis complex consensus conference. Pediatric Neurology. 2013; 49: 243-25
9. Wong, M. Mammalian target of rapamycin (mTOR) pathways in neurological diseases. Biomed Journal. 2013; 36(2): 1-17.
10. Ostendorf, A. and Wong, M. mTOR inhibition in epilepsy: rationale and clinical perspectives. CNS Drugs. 2015:91-99




