Redacción Farmacosalud.com
Entre las pacientes con cáncer de mama en estadio temprano que, según criterios clínicos y biológicos, fueron determinadas como pacientes con un alto riesgo de recurrencia, el test genético Mammaprint identificó a un importante grupo en el que la supervivencia libre de metástasis a distancia a cinco años fue igual de buena que en el grupo de las que no habían recibido quimioterapia adyuvante (administrada tras la cirugía), según los resultados del estudio clínico randomizado, de fase III, “microarray en la enfermedad con ganglios negativos puede evitar la quimioterapia (MINDACT)”, presentado en el Congreso Anual de la American Association for Cancer Research (AACR) 2016 (16-20 de abril).
“En la actualidad, la mayoría de los oncólogos recomiendan quimioterapia adyuvante basándose en criterios clínicos y biológicos comunes tales como la edad de la paciente, el estadio y el grado de su enfermedad, así como el estado del receptor hormonal HER2 de su tumor”, explica Martine Piccart, MD, PhD, jefa del Departamento de Medicina del Instituto Jules Bordet en Bruselas (Bélgica), y cofundadora y presidenta del Breast International Group (BIG). “Los resultados del estudio MINDACT proporcionan evidencia científica de nivel 1A de que el uso de Mammaprint podría cambiar la práctica clínica reduciendo substancialmente el uso de la quimioterapia adyuvante y evitar un tratamiento agresivo a muchas pacientes que no se beneficiarían de él.”
Reducción de un 46% en la prescripción de quimioterapia en pacientes de alto riesgo
De entre las 3.356 pacientes incluidas en el estudio MINDACT que fueron clasificadas como de “alto riesgo de recurrencia de la enfermedad” en base a los criterios clínicos y patológicos comunes (C-high), el tratamiento de acuerdo a Mammaprint redujo la prescripción de quimioterapia en un 46%. La supervivencia libre de metástasis a distancia a cinco años para el grupo de pacientes en el que existía una discordancia entre el riesgo de recurrencia evaluada a través del resultado de Mammaprint frente a la determinación por criterios comunes (G-low/C-high) superó el 94%, indistintamente de si recibieron o no quimioterapia.
Fuente: Archivo
Piccart comenta que, considerando todas las pacientes incluidas en el estudio MINDACT, el 14% podría evitar la quimioterapia calculando su riesgo de recurrencia mediante la firma genética Mammaprint, que analiza 70 genes, en comparación con el uso de los métodos clínicos tradicionales. De 2007 a 2011, Piccart y colaboradores de 111 centros en nueve países incluyeron en el estudio a 6.693 mujeres que se habían sometido a cirugía para el cáncer de mama en estadio temprano (de las 11.288 que fueron evaluadas). Todas las participantes fueron clasificadas como “bajo” o “alto” riesgo de recurrencia del tumor siguiendo dos métodos: en primer lugar, a través del análisis del tejido tumoral usando el test Mammaprint de forma centralizada en Amsterdam y, en segundo lugar, a través de Adjuvant! Online, una herramienta que calcula el riesgo de recurrencia del cáncer de mama basado en criterios clínicos y biológicos comunes, informa la agencia Berbés Asociados.
Las participantes fueron divididas en cuatro grupos: 2.745 fueran clasificadas en el grupo “bajo riesgo de recurrencia” según los dos métodos de evaluación del riesgo (G-low/C-low), 1.806 fueron clasificadas en el grupo “alto riesgo de recurrencia” según los dos métodos de evaluación del riesgo (G-high/C-high), 592 se clasificaron como “alto riesgo de recurrencia” según MammaPrint y “bajo riesgo de recurrencia” según Adjuvant!Online (G-high/C-low), y 1.550 se clasificaron como “bajo riesgo de recurrencia” según MammaPrint y “alto riesgo de recurrencia” según Adjuvant!Online (G-low/C-high). A las pacientes clasificadas como G-low/C-low no se les asignó tratamiento adyuvante con quimioterapia y a las clasificadas como G-high/C-high se les asignó quimioterapia adyuvante. Por otro lado, las pacientes clasificadas como G-high/C-low o G-low/C-high fueron aleatorizadas a uno de los dos grupos: para recibir quimioterapia adyuvante o no.
El estudio MINDACT, pionero en varios aspectos
Según Piccart, MINDACT es el primer ensayo clínico controlado, prospectivo y aleatorizado en cáncer de mama en el que se evalúa la recurrencia en base a un análisis genómico con un nivel 1A de evidencia clínica. También es el primer estudio prospectivo de investigación traslacional de esta magnitud que ha conseguido obtener resultados sobre su objetivo primario. En este sentido, la investigadora añadió que el ensayo representa una enorme fuente de datos para futuras investigaciones, puesto que utilizando las muestras de tumor, sangre y los datos de los resultados clínicos de las participantes en el ensayo, se podrá obtener un mayor conocimiento de la biología del cáncer de mama.

Doctora Ana Lluch
Fuente: Dra. Lluch / Fundación Investigación H. Clínico de Valencia
Instituto de Investigación Sanitaria INCLIVA (Archivo)
Retrasar la administración de quimioterapia, un reto en cáncer de mama luminal
El cáncer de mama Luminal A supone entre el 65 y 70% de todos los cánceres de mama. Es, por tanto, un amplio grupo de pacientes en el que el abordaje integral y la optimización de los tratamientos actuales pueden aportar grandes beneficios. “Los cánceres luminales suponen el subtipo de tumores de mama que afectan al mayor número de mujeres. Sin embargo, suelen tener una evolución lenta de su enfermedad y las recaídas suelen ser más tardías”, asegura la Dra. Ana Lluch, jefa del Servicio de Oncología del Hospital Clínico Universitario de Valencia y coordinadora científica de la jornada ‘Abordaje integral del cáncer de mama luminal’, organizada por la compañía biofarmacéutica AstraZeneca.
“Aunque el estadiaje según TNM −Tumor primario (T), Ganglios linfáticos regionales (N) y Metástasis distante (M)− es importante, en estos tumores nos resulta más útil contar con las características biológicas del tumor. Afortunadamente, estas pacientes se benefician de la terapia hormonal y, en este momento, hay varios tratamientos eficaces, por lo que cuando falla uno, podemos administrar otro. A pesar de ello, atacar las resistencias y vencerlas es uno de nuestros principales retos”, asegura Lluch.
Si el presente en el tratamiento del cáncer de mama luminal es ya muy positivo, los avances en la biología molecular de los tumores y los avances en el tratamiento hacen del futuro un periodo esperanzador. “La base del tratamiento es la terapia hormonal y, aunque los tratamientos que utilizamos no son nuevos, son fármacos muy conocidos por los oncólogos, lo que estamos haciendo ahora es utilizarlos mejor y optimizar su uso. En este sentido, contamos con inhibidores de la aromatasa, el conocido tamoxifeno y medicamentos como fulvestrant, cuyo uso lo hemos optimizado mucho estos últimos años. Los avances son esperanzadores”, señala la oncóloga. A pesar de los buenos resultados de los tratamientos actuales, los especialistas se marcan nuevos retos dirigidos a mejorar, aún más, las cifras de supervivencia en este tipo de tumores. En este sentido, para Lluch “el principal reto es vencer la resistencia al tratamiento y determinar cómo y de qué manera vencerla. De esta forma, retrasaríamos la administración de quimioterapia el máximo tiempo posible, algo que constituye uno de los principales caballos de batalla en este tipo de cáncer”.
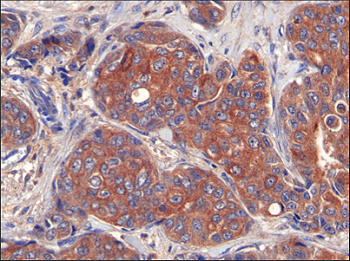
Los tumores de mama expresan altos niveles de proteína LIPG
F Slebe, IRB Barcelona
Fuente: IRB Barcelona
Los tumores de mama dependen del suministro de grasas para poder crecer
Por otro lado, una investigación[1] liderada por el Instituto de Investigación Biomédica (IRB Barcelona) en colaboración con hospitales españoles y la URV ha puesto al descubierto una dependencia del cáncer de mama que podría abrir nuevas opciones terapéuticas para combatirlo. Los científicos describen en ‘Nature Communications’ que las células de mama tumorales necesitan recoger grasas del exterior y trasladarlas a su interior para poder seguir proliferando. La principal proteína en este proceso es LIPG (leído, lip ge), una enzima localizada en la membrana (la capa exterior que envuelve las células) sin cuya actividad la célula tumoral no puede crecer. Los análisis de más de 500 muestras clínicas de pacientes con distintos tipos de tumores de mama revelan que el 85% tienen altos niveles de LIPG, ha informado IRB Barcelona mediante un comunicado.
Se conocía que, para crecer, las células tumorales captan glucosa del exterior, al igual que se sabía que reprograman su maquinaria interna para producir muchos más lípidos (grasas). La novedad del descubrimiento radica en que por primera vez se pone al descubierto la necesidad de las células tumorales de importar lípidos externos. “Este nuevo conocimiento relacionado con el metabolismo podría representar un talón de Aquiles para el cáncer de mama” explica el investigador ICREA y jefe de grupo del IRB Barcelona, Roger Gomis, colíder del trabajo junto a Joan J. Guinovart, director del IRB Barcelona y catedrático de la Universidad de Barcelona. Los científicos demuestran en modelos animales y en células tumorales que bloqueando la actividad de la LIPG el tumor deja de crecer.
Referencias
1. ‘FoxA and LIPG endothelial lipase control the uptake of extracellular lipids for breast cancer growth’. Felipe Slebe, Federico Rojo, Maria Vinaixa, Mar García-Rocha, Giorgia Testoni, Marc Guiu, Evarist Planet, Sara Samino, Enrique J. Arenas, Antoni Beltran, Ana Rovira, Ana Lluch, Xavier Salvatella, Oscar Yanes, Joan Albanell, Joan J. Guinovart & Roger R. Gomis. Nature Comms (2016, April 5) Doi: 10.1038/NCOMMS11199




