Introducción:
La llegada de los primeros medicamentos biosimilares al tratamiento de la enfermedad inflamatoria intestinal (EII) ha supuesto un cambio en el escenario actual tanto para pacientes como médicos y por supuesto para las administraciones/pagadores. El primer biosimilar aprobado por la E.M.A. ha sido el infliximab (IFX), y se ha aprobado para las siguientes indicaciones: artritis reumatoide, espondilitis anquilosante, artritis psoriásica, psoriasis en placas moderada-grave, enfermedad de Crohn (EC) adultos y pediatría y colitis ulcerosa (CU) adultos y pediatría.
Una de las principales reivindicaciones de los gastroenterólogos desde su aprobación ha sido la ausencia de estudios específicos en EC y CU, puesto que los dos ensayos clínicos pivotales que las agencias reguladoras consideraron necesarios fueron realizados en artritis reumatoide y espondilitis anquilosante [1,2]. Estos ensayos mostraron que entre el IFX original y el biosimilar no existían diferencias en fármaco-cinética, en la respuesta clínica y en efectos adversos, ni diferencias en la producción de anticuerpos anti medicamento. Por otra parte, probablemente sea la EII la patología donde en la actualidad se emplee con más frecuencia el IFX, no solo por su comprobada eficacia, sino porque a diferencia de otras patologías, el número de terapias biológicas aprobadas y eficaces es escaso y por lo tanto el porcentaje de pacientes subsidiarios de IFX a día de hoy es mayor que en enfermedades reumatológicas o dermatológicas. En la actualidad se están realizando estudios internacionales y ensayos clínicos específicos en EII (Registro CT-P13, estudio CT-P13 y estudio NOR-Switch); sin embargo, aún no se dispone de resultados publicados. Todo esto ha contribuido a que en estos últimos meses se hayan publicado los primeros estudios y series de casos de vida real que se comentarán en profundidad. Además, en todos los congresos de nuestra especialidad se están presentando ‘abstracts’ de estudios de experiencia clínica.
Estudios publicados en práctica clínica:

Doctor Manuel Barreiro de Acosta
Fuente: Kern Pharma
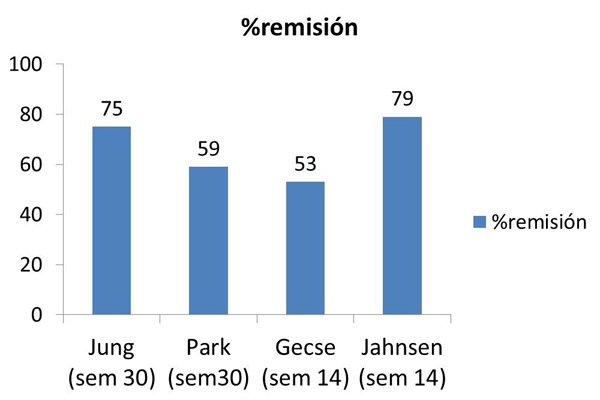
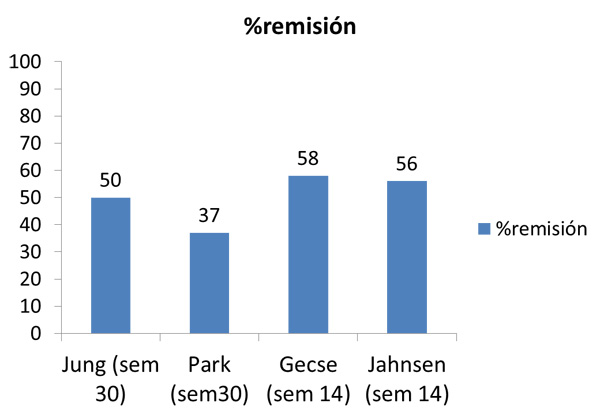
En el primer país donde se ha empezado a utilizar el biosimilar de IFX ha sido Korea del Sur, al ser el lugar de origen del laboratorio que fabrica el fármaco. Una primera serie de 17 pacientes (8 EC) que incluía tanto pacientes naïve (nunca tratados previamente con IFX) como pacientes switch (estaban recibiendo previamente el original y se cambiaron a biosimilar) mostró que en los naïve, tras la inducción, el 87% tenían respuesta o remisión y en los switch solo observaron en un paciente pérdida de repuesta, siendo los efectos adversos escasos [3]. Otra serie multicéntrica koreana posterior que evaluaba retrospectivamente 110 pacientes (59 EC) tanto switch como naïve mostró en este grupo de pacientes unas tasas de remisión en la semana 30 del 75% en los pacientes con EC y cercanas al 50% en los pacientes con CU. En los pacientes con cambio de fármaco observaron que el 90% mantenían la eficacia. Se describieron 6 reacciones infusionales, todas en pacientes con CU, siendo dos de ellas en pacientes switch [4]. Recientemente se ha publicado otro estudio abierto multicéntrico tanto de pacientes naïve como switch que incluyó 173 pacientes: 83 EC luminal (43 naïve y 40 switch), 12 EC perianal (8 naïve y 4 switch) y 78 CU (62 naïve y 16 switch) de los cuales el 60% recibían inmunosupresores concomitantes. Los principales resultados de este estudio fueron unas tasas de remisión en la semana 30 del 59% en EC y del 37% en CU y tasas de respuesta del 80% en EC y del 70% en CU. En los pacientes con switch en EC el 87% mantuvieron respuesta, mientras que en CU solo la mantuvieron el 45%. Otro dato interesante de este estudio fue que reportaron que casi un 40% de los pacientes requirieron intensificar el tratamiento. En cuanto a seguridad, se describieron reacciones infusionales en el 5% de los pacientes y apenas otros efectos adversos graves [5].
Los primeros estudios publicados en Europa provienen de los países del Este, donde el impacto económico de la introducción de estos fármacos ha sido más considerable. En un primer estudio en el que se evaluó la inducción en 39 pacientes (21 UC), todos naïve, se observaron tasas entre respuesta e inducción superiores al 80% en las dos entidades. Además, también aporta información sobre curación mucosa en CU [6]. De Hungría también proviene el estudio probablemente más completo publicado hasta la actualidad: se trata de un estudio prospectivo, observacional, multicéntrico que evalúa inducción y mantenimiento en 210 pacientes (126 EC). Casi todos naïve, algunos habían recibido Remicade previo (pero no switch directo), y además de la clínica (CDAI, Mayo) aporta datos de curación mucosa y de niveles [7]. En la semana 14 el 81% con EC y el 77% con CU presentaron respuesta clínica y las tasas de remisión fueron 53% en EC y 58% en CU. Un dato interesante fue que las reacciones infusionales fueron mucho mayores entre los expuestos previamente a Remicade (27%) y solo de un 2% en no expuestos (p<0,001).
Un estudio de Noruega prospectivo y unicéntrico evaluó la inducción en 78 pacientes (46 EC) naïve; en la semana 14 estaban en remisión el 79% de los pacientes con EC y el 56% con CU. Además aportó interesantes datos en cuanto a descenso de proteína C reactiva y calprotectina fecal en ambas patologías [8].
En cuanto a datos con switch, destaca un estudio realizado en Polonia en población pediátrica. Se incluyeron 39 pacientes (32 EC) de una edad media de 11 años y con una media de infusiones previas de Remicade de 9. En el momento del cambio 69% estaban en remisión. La mediana de nuevas dosis de biosimilar fue 5 y al final del seguimiento 63% seguían en remisión. En CU llamó la atención que un 25% necesitaron intensificar y solamente registraron 1 efecto adverso infusional en dosis 4 tras switch [9].
Se han referido muchos datos en abstracts en los últimos congresos, sobre todo en la ECCO, que son difíciles de analizar por las limitaciones de palabras que no permiten evaluar la metodología empleada. Destacan los datos del Hospital Virgen de Macarena de Sevilla, que con más de 100 pacientes en los que se realizó switch, más del 70% mantienen la remisión.
En las figuras 1 y 2 se muestran las tasas de remisión obtenidas en los principales estudios publicados hasta la actualidad tanto en EC como en CU.


Interpretación de los resultados:
Con todas las limitaciones que suponen los estudios en práctica clínica debido a que sus diseños en ocasiones son retrospectivos y que la valoración clínica muchas veces se basa solamente en datos clínicos, se han observado tasas altas de remisión y respuesta. En general, se han descrito mejores resultados en naïve y peores en ‘retratamiento’. En cuanto a los resultados en switch, se necesitan más datos porque aunque los resultados son esperanzadores, existe cierta discordancia entre trabajos. Se han descrito pocos efectos adversos, lo que confirma un perfil de seguridad similar a los estudios con IFX original.
Las tasas de remisión son en general elevadas, incluso con tasas superiores a los ensayos clínicos de IFX; sin embargo, no debemos comparar estos estudios con los estudios pivotales ACCENT y ACT de Remicade, ya que es conocido que los estudios de práctica clínica suelen incluir grupos de pacientes distintos a los de los criterios de los ensayos clínicos y las tasas de remisión siempre son más elevadas [10,11]. Sin embargo, cuando se comparan los resultados con biosimilar con series abiertas con Remicade, las tasas de remisión son muy superponibles tanto en EC [12] como en CU [13].
Los resultados en práctica clínica con el biosimilar de IFX han confirmado su eficacia en la EII, fundamentalmente en los pacientes naïve. Este hecho, unido al indudable ahorro que supone la entrada de estos nuevos fármacos, como ha quedado demostrado en estudios farmacoeconómicos recientes [14], supone un nuevo escenario en el tratamiento de estas enfermedades tan complejas. En los próximos meses tendremos nuevos e interesantes datos sobre el uso de biosimilares en EII, incluyendo los resultados de registros y ensayos clínicos que se están llevando a cabo en la actualidad.
Bibliografía:
1. Yoo DH, Hrycaj P, Miranda P, Ramiterre E, Piotrowski M, Shevchuk S, et al. A randomised, double-blind, parallel-group study to demonstrate equivalence in efficacy and safety of CT-P13 compared with innovator infliximab when coadministered with methotrexate in patients with active rheumatoid arthritis: the PLANETRA study. Ann Rheum Dis. 2013;72:1613-20.
2. Park W, Hrycaj P, Jeka S, Kovalenko V, Lysenko G, Miranda P, et al. A randomised, double-blind, multicentre, parallel-group, prospective study comparing the pharmacokinetics, safety, and efficacy of CT-P13 and innovator infliximab in patients with ankylosing spondylitis: the PLANETAS study. Ann Rheum Dis. 2013;72:1605-12.
3. Kang YS, Moon HH, Lee SE, Lim YJ, Kang HW. Clinical Experience of the Use of CT-P13, a Biosimilar to Infliximab in Patients with Inflammatory Bowel Disease: A Case Series. Dig Dis Sci. 2015;60:951-6.
4. Jung YS, Park DI, Kim YH, Lee JH, Seo PJ, Cheon JH, et al. Efficacy and safety of CT-P13, a biosimilar of infliximab, in patients with inflammatory bowel disease: A retrospective multicenter study. J Gastroenterol Hepatol. 2015;30:1705-12.
5. Park SH, Kim YH, Lee JH, Kwon HJ, Lee SH, Park DI, et al. Post-marketing study of biosimilar infliximab (CT-P13) to evaluate its safety and efficacy in Korea. Expert Rev Gastroenterol Hepatol. 2015;9:35-44.
6. Farkas K, Rutka M, Bálint A, Nagy F, Bor R, Milassin Á, et al. Efficacy of the new infliximab biosimilar CT-P13 induction therapy in Crohn's disease and ulcerative colitis - experiences from a single center. Expert Opin Biol Ther. 2015;15(9):1257-62.
7. Gecse KB, Lovász BD, Farkas K, Banai J, Bene L, Gasztonyi B, et al.Efficacy and Safety of the Biosimilar Infliximab CT-P13 Treatment in Inflammatory Bowel Diseases: A Prospective, Multicentre, Nationwide Cohort. J Crohns Colitis. 2016;10:133-40.
8. Jahnsen J, Detlie TE, Vatn S, Ricanek P. Biosimilar infliximab (CT-P13) in the treatment of inflammatory bowel disease: A Norwegian observational study. Expert Rev Gastroenterol Hepatol. 2015;9:45-52.
9. Sieczkowska J, Jarzębicka D, Banaszkiewicz A, Plocek A, Gawronska A, Toporowska-Kowalska E, et al. Switching Between Infliximab Originator and Biosimilar in Paediatric Patients with Inflammatory Bowel Disease. Preliminary Observations. J Crohns Colitis. 2016;10:127-32.
10. Hanauer SB , Feagan BG , Lichtenstein G, Mayer LF, Schreiber S, Colombel JF, et al. Maintenance infliximab for Crohn’s disease: the ACCENT I randomised trial. Lancet 2002;359:1541-9.
11. Rutgeerts P, Sandborn WJ, Feagan B, Reinisch W, Olson A, Johanns J, et al. Infliximab for induction and maintenance therapy for ulcerative colitis. N Engl J Med 2005;233:246-73.
12. Schnitzler F, Fidder H,Ferrante M, Noman M, Arijs I, Van Assche G, et al. Long-term outcome of treatment with infliximab in 614 patients with Crohn’s disease : results from a single-centre cohort. Gut 2009;58:492–500.
13. Barreiro-de Acosta M, Lorenzo A, Mera J, Domínguez-Muñoz JE. Mucosal Healing and Steroid-Sparing Associated with Infliximab for Steroid-Dependent Ulcerative Colitis. J Crohns Colitis. 2009;3:271-6.
14. Brodszky V, Rencz F, Péntek M, Baji P, Lakatos PL, Gulácsi L. A budget impact model for biosimilar infliximab in Crohn's disease in Bulgaria, the Czech Republic, Hungary, Poland, Romania, and Slovakia. Expert Rev Pharmacoecon Outcomes Res. 2016;16:119-25.






