Redacción Farmacosalud.com
Hoy en día hay tres vías abiertas para intentar combatir la colitis ulcerosa, cada una de ellas con sus pros y sus contras: un probiótico tipo fármaco, el trasplante fecal y un prebiótico. De hecho, un estudio del proyecto europeo MetaHIT en el que ha participado el Hospital Vall d’Hebron (Barcelona) ha demostrado que la ausencia de la bacteria Akkermansia muciniphila puede estar relacionada con la aparición de la colitis ulcerosa. Así pues, para poder recuperar esta importante bacteria se contemplan esas tres opciones, desvela a www.farmacosalud.com el doctor Francisco Guarner, jefe de sección de la Unidad de Investigación del Aparato Digestivo del Hospital Vall d’Hebron y presidente de la Sociedad Española de Probióticos y Prebióticos (SEPyP).
La primera de ellas es cultivar Akkermansia muciniphila y producirla en cantidades suficientes para darla específicamente como probiótico (los probióticos son microorganismos, seres vivos que aportan beneficios a nuestro organismo). “Eso es lo que estamos trabajando con un grupo en la Universidad de Wageningen, en Holanda. Este camino es largo porque se tiene que pasar por toda una serie de validaciones para garantizar la seguridad y también la eficacia de la intervención. Dado que sería un probiótico tipo fármaco, hay que tener en cuenta que, en general, la media de tiempo para la aparición de un nuevo fármaco son 6-7 años”, explica Guarner.

Doctor Francisco Guarner
Fuente: Sociedad Española de Probióticos y Prebióticos (SEPyP) / Archivo
Trasplantes fecales
En segundo lugar, se ha contemplado realizar trasplantes fecales de personas que tienen esta bacteria en grandes cantidades a personas que no la tienen. Según el doctor Guarner, “desde un punto de vista regulatorio esta vía es más fácil, o sea, cuesta mucho menos poner en marcha un proyecto de este tipo porque básicamente se necesita permiso local; digamos que no hay que ir a la Agencia Europea del Medicamento, sino que es más una terapia compasiva. Sería un proceso rápido pero nosotros no hemos querido hacer esto, lo hemos desechado completamente porque cuando a alguien le pones heces de otra persona no sólo le pones la bacteria que tú quieres poner, sino que le pasas muchas otras bacterias, muchos virus, muchos hongos, muchas cosas que nos son desconocidas. No lo queremos hacer con enfermos porque vemos que hay un riesgo que no tenemos controlado. Sí que se está haciendo en Austria, Bélgica y Francia”.
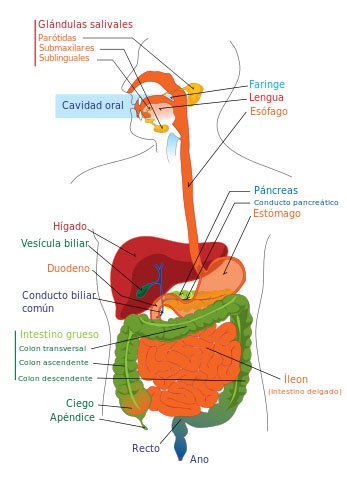
A criterio del presidente de la SEPyP, la tercera opción “es la más próxima y la más rápida: desarrollar alimentos que no alimentan al individuo, al enfermo, sino que bajan hasta el colon y favorecen el crecimiento de la bacteria Akkermansia, que vive en el moco intestinal. Tenemos algún dato previo en ratones en el que se ve que usando algún tipo de fibras solubles crece la cantidad de esta bacteria. Sería un prebiótico, es el concepto de prebiótico: se da por vía oral como un alimento que no es absorbido por el intestino de la persona, sino que baja hasta el área donde están las bacterias y favorece el crecimiento de algunos de estos microorganismos”.
Akkermansia no está en las áreas inflamadas, pero sí en partes más altas del intestino
Ahora bien, esta vía presenta un problema: ¿Y si no hay Akkermansia a la que alimentar por ausencia de esta bacteria, como sucede en el caso de la colitis ulcerosa? “Si no hay ninguna Akkermansia -prosigue el experto-, en realidad quizás se esté bajo el límite de detección de la bacteria, y esto pasa… Si la favoreces puede que aparezca, o puede ser que no porque puede haberse perdido completamente. Esta tercera vía es la más sencilla de empezar ya, pero no es la que tiene más garantías de eficacia. Este proyecto sí que se podría empezar a poner en marcha este año: no tenemos problemas de seguridad y ya estamos pensando en diseños de fibras que podrían funcionar, probablemente primero en ratones”.
Autor/a: User: LadyofHats (English version); User: Bibi Saint-Pol (Spanish version, translation by User: AlvaroRG)
Fuente: Wikipedia
Si bien la opción prebiótico “puede fallar en personas que son completamente negativas en Akkermansia”, hay que tener en cuenta un hecho muy importante que permite ver el vaso medio lleno y no medio vacío, viene a decir Guarner: “En una colitis ulcerosa normalmente se inflama la parte más distal del intestino, que es el recto, mientras que las partes más proximales no se inflaman. En algunos de estos enfermos vemos que la bacteria no está en las áreas inflamadas, pero sí en partes más altas del intestino, donde se conserva. La idea es que si damos un alimento y favorecemos la expansión de esta bacteria, probablemente recolonicemos también la parte baja”.
“Si logramos los recursos económicos (aproximadamente medio millón de euros), empezaríamos los ensayos clínicos y el desarrollo de los alimentos funcionales que nos ayudarían a prevenir este tipo de enfermedades inflamatorias intestinales”, comenta Guarner, según declaraciones recogidas en el marco del ‘XIII Curso Internacional Miquel Àngel Gassull’. Hasta ahora, la investigación en alimentos funcionales para las enfermedades intestinales ha ido dirigida fundamentalmente al enriquecimiento de la dieta con compuestos beneficiosos para nutrir a la persona humana, sin tener en cuenta la nutrición de las bacterias que conviven con ella. Ahora, con este importante estudio del Hospital del Vall d’Hebron se puede pensar en intervenciones nutricionales dirigidas a favorecer la proliferación de determinadas bacterias beneficiosas que pueden ser críticas para la prevención y tratamiento de las enfermedades inflamatorias del intestino.
Antibióticos: erradican bacterias patógenas… ¿y también no patógenas?
Las bacterias son seres vivos con pocos recursos genéticos (entre 500 y 4.000 genes), por lo que necesitan convivir con otras especies para poder sobrevivir. Estas bacterias, a las que se les denomina simbiontes, se adaptan al anfitrión y precisamente como consecuencia de este hospedaje van reduciendo su carga genética, llegando incluso a ser completamente dependientes del organismo anfitrión.
Con la ayuda de antibióticos se han podido erradicar bacterias patógenas que provocaban enfermedades -ya casi desaparecidas- como la sífilis, el tifus, la lepra o la fiebre de Malta, entre otras. Sin embargo, señala el doctor, “no sabemos si también se han eliminado bacterias no patógenas que podrían ayudarnos a regular nuestro sistema inmunitario y prevenir otras enfermedades de base autoinmune como las alergias y las enfermedades inflamatorias del intestino, por ejemplo. Quizá la Akkermansia muciniphila es uno de esos simbiontes que regulan la inmunidad y su ausencia podría estar en el origen de la inflamación intestinal descontrolada.”
En Europa, las EII afectan a más de 2,2 millones de personas
La enfermedad de Crohn y la Colitis Ulcerosa son enfermedades inflamatorias intestinales (EII) de carácter crónico para las que no hay un tratamiento curativo. Son enfermedades que típicamente afectan a personas jóvenes, por lo que su impacto en la vida laboral, social y de relación y, en definitiva, en la calidad de vida de los pacientes es considerable. En Europa, las EII afectan a más de 2,2 millones de personas. En España, son diagnosticados unos 2.000 nuevos casos al año; más de 15 de cada 100.000 españoles padecen enfermedad de Crohn y más de 10 de cada 100.000 tienen colitis ulcerosa.

Fuente: bocemtium.com
200 expertos internacionales en EII han participado recientemente en el ‘XIII Curso Internacional Miquel Àngel Gassull’, curso decano en España en la investigación y tratamiento de estas patologías. El encuentro ha sido organizado por el Hospital Germans Trias i Pujol (Badalona, en Barcelona) y por la Fundació d’Investigació en Ciències de la Salut Germans Trias i Pujol (IGTP), y ha contado con el apoyo del Grupo de Trabajo en Enfermedad de Crohn y Colitis Ulcerosa (GETECCU) y el Instituto de Promoción de la Ciencia y la Innovación (IPCI). El doctor Eduard Cabré, director del curso junto con el Dr. Eugeni Domènech, ambos del Hospital Germans Trias i Pujol, explica que en este momento se está avanzando en la búsqueda de nuevas líneas de investigación para el tratamiento y diagnóstico de las Enfermedades Inflamatorias Intestinales, como los aspectos nutricionales, epigenéticos o los nuevos tratamientos biológicos, entre otros”.
La colitis ulcerosa, una enfermedad progresiva y limitante
La monitorización farmacológica, el control estricto y el conocimiento del perfil del paciente destacan como las formas más importantes para intervenir de forma precoz y resolver los síntomas de los pacientes con colitis ulcerosa (CU). Esta es una de las principales conclusiones expuestas por el doctor Julián Panés, jefe del Departamento de Gastroenterología del Hospital Clínic de Barcelona, durante un simposio organizado por la compañía AbbVie en el Congreso Europeo de Gastroenterología. La relación médico-paciente y la educación sanitaria son factores determinantes en el abordaje de la colitis ulcerosa y en la evolución del paciente. Además, es importante que el médico entienda al enfermo e integre la terapia médica con la atención psicológica [i,ii].

Autor: Cia de Foto
Fuente: Flickr / Creative Commons
La CU es una enfermedad que afecta la calidad de vida de los pacientes; más del 50% considera que la CU puede controlar sus vidas, con el consiguiente impacto psicológico que esto conlleva. El 55% de los pacientes con colitis ulcerosa afirma haber padecido alguna alteración en su calidad de vida. Sin embargo, los médicos y las enfermeras percibieron la CU como un trastorno que afecta la calidad de vida en un 35% y 37% de los pacientes, respectivamente. “La CU es una patología que cursa a brotes, y que en ocasiones afecta de forma notable la calidad de vida del paciente. Resulta fundamental informar al paciente para que se involucre en todos los pasos de su tratamiento, tanto en el marco de la consulta con el especialista, como en su casa, para mantener la enfermedad bajo control y estar atento a su evolución“ afirma Panés.
Los síntomas más molestos que señalan la mayoría de los pacientes son la urgencia para ir al baño y el dolor, mientras que sólo el 6% de los médicos y el 11% de las enfermeras consideran el dolor uno de los síntomas más limitantes de la CU. Los síntomas más comunes de un enfermo de colitis ulcerosa son diarrea mucosanguinolenta, dolor abdominal y urgencia rectal. Además, en ocasiones afecta a la pérdida de peso, produce fiebre (en casos de brotes graves) e influye en el estado general. A pesar de todo ello, Panés señala que “a día de hoy, con diagnóstico temprano y con un empleo adecuado de todas las opciones terapéuticas, se puede mejorar notablemente la calidad de vida del paciente”.
La autoestima, las relaciones personales, el trabajo y los ratos de ocio se ven perjudicados constantemente por la patología, de tal forma que el 41% de los enfermos consideran que la CU determina el tipo de trabajo que desempeñan, el 55% ha tenido que solicitar una baja laboral a causa de su enfermedad y el 38% reconoce que ha disminuido su autoestima desde que padece dicha afección[iii]. El doctor Panés asegura que “la mejora de la comunicación entre el paciente y su médico o enfermera especialista y la educación sanitaria del paciente son fundamentales para un correcto abordaje”.
Exacerbación y remisión de la CU[i]
Los médicos y enfermeras tienen una percepción de la carga que supone la patología para los enfermos, situando el número habitual de exacerbaciones sufridas al año entre un 3,4 y un 3,8, respectivamente, frente al 5,5 que establecen los pacientes de CU. Los afectados por la enfermedad opinan que el estrés es la causa más común de las exacerbaciones de esta dolencia, mientras que los médicos consideran como causas más comunes la evolución natural de la enfermedad y no tomar el tratamiento.
Referencias
i. Kiebles JL, Doerfler B, Keefer L. Preliminary evidence supporting a framework of psychological adjustment to inflammatory bowel disease. Inflamm Bowel Dis. 2010 Oct;16(10):1685-95.
ii. Sajadinejad MS, Asgari K, Molavi H, Kalantari M, Adibi P. Psychological issues in inflammatory bowel disease: an overview. Gastroenterol Res Pract. 2012;2012:106502.
iii. Carpio, D Poster (P645), presentado en la 10nd ECCO 2015 Barcelona (España)




