Redacción Farmacosalud.com
Casi 1,4 millones de personas mueren en el mundo por hepatitis viral. La Organización Mundial de la Salud (OMS) pide en este 28 de julio, Día Mundial contra la Hepatitis, fortalecer las actividades de prevención, detección y control de la hepatitis viral y sus enfermedades conexas, aumentar la cobertura vacunal contra la hepatitis B, incorporar la vacuna en los programas nacionales de inmunización y coordinar una respuesta mundial contra la hepatitis. La hepatitis se muestra con diferentes tipos de virus. La hepatitis A se transmite por alimentos y por agua contaminada. Es el tipo más frecuente en la infancia, casi siempre benigna y autolimitada. La transmisión es la vía fecal-oral, entérica de persona a persona, se ve favorecida por la mala higiene y se relaciona con un bajo nivel socio-económico. Según los últimos datos del Instituto de Salud Carlos III (ISCIII), el grupo más afectado fue el de 5 a 9 años (7,03 casos por 100.000 habitantes en hombres y 6,15 en mujeres), seguido del de 1 a 4 años (5,65 casos por 100.000 habitantes en hombres y 4,24 en mujeres) y del de 10 a 14 años (3,36 casos por 100.000 habitantes en hombres y 2,06 en mujeres).
Las tasa de transmisión entre miembros de familia es del 45% en niños y hasta el 20% en adultos. La prevalencia en España es aproximadamente de un 5% en la infancia, llegando hasta un 15% en la adolescencia, lo que viene resultando una cifra de unos 25 casos por cada 100.000 habitantes. La mejor manera de prevenirla es la vacunación. La vacuna es innocua, bien tolerada y confiere inmunidad duradera en casi el 100% de los casos. Las hepatitis B, C y D se transmiten a través de líquidos corporales infectados, como la sangre, por contacto sexual, de madre a hijo durante el parto, o a través de material médico contaminado. La hepatitis B (VHB) es un problema de salud mundial, no solo por la infección aguda, sino también por la frecuencia de cronificación. La tasa de paso de la enfermedad aguda a la cronicidad varía con la edad; en la adquirida perinatalmente llega hasta el 90%, mientras que, en la adquirida entre 1 y 5 años no sobrepasa el 20-50%, y para los adultos esta frecuencia baja al 5%. De los portadores crónicos, al menos un 15% van a presentar a lo largo de su vida complicaciones. El VHB es aún el líder como causante de cirrosis a nivel mundial.
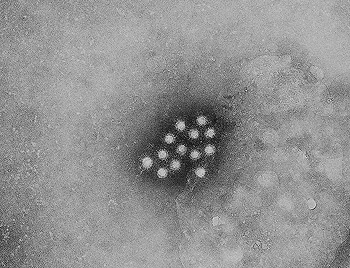
Micrografía electrónica de viriones de hepatitis A
Autor/a de la imagen: Content Providers(s): CDC/Betty Partin - This media comes from the Centers for Disease Control and Prevention's Public Health Image Library (PHIL), with identification number #2739.
Fuente: Wikipedia
Situaciones de especial riesgo
En la infancia, las situaciones de especial riesgo de infección por el virus B son:
-Recién nacidos de madres portadoras.
-Niños inmigrantes o adoptados de áreas de elevada prevalencia.
-Adolescentes drogadictos o con prácticas de riesgo (tatuajes, piercing, etc.).
-Niños recluidos en instituciones.
La transmisión se puede llevar a cabo por 4 vías: vertical (madre-hijo), horizontal por contacto, por hemoderivados o punciones venosas y sexual.
1. Transmisión vertical: por transferencia materno-fetal en el útero, por contacto con la sangre materna en el canal del parto o bien tras el nacimiento. La lactancia materna no parece aumentar el riesgo de transmisión.
2. Transmisión horizontal: por contacto con otra persona infectada, a través de pequeños cortes o erosiones en piel y mucosas. También, es posible el contagio a través de utensilios contaminados (cepillos de dientes, juguetes, etc.), ya que el VHB puede sobrevivir prolongadamente fuera del cuerpo humano. Es más frecuente en la edad escolar.
3. Transmisión por trasfusiones de sangre no segura, uso de agujas u otros utensilios médicos contaminados. En nuestro medio, es excepcional.
4. Transmisión sexual, que en pediatría carece de interés, salvo en adolescentes.
La mejor manera de controlar la infección por VHB es la vacunación, implantada de manera universal en nuestro medio desde principios de los 90.
Hepatitis D (VHD)
El VHD requiere la presencia obligatoria del antígeno de superficie del VHB para su transmisión in vivo. Aproximadamente, un 4% de los infectados crónicamente por VHB, evidencian exposición al VHD. Se asocia a una hepatitis aguda más grave y mayor mortalidad y riesgo de cirrosis que en la infección por VHB.
Hepatitis C (VHC)
Identificado en 1989, tiene una enorme diversidad genética y capacidad para mutar constantemente, lo que favorece la persistencia de la infección. En la actualidad, el VHC es el responsable de prácticamente todas las hepatitis crónicas de origen vírico en la infancia en nuestro medio, desde la vacunación universal frente al VHB. La infección por VHC se calcula que afecta a unos 200 millones de personas en todo el mundo, y en la población infantil en España se detectan anticuerpos VHC en un 0,1-0,4%. El VHC se transmite por vía parenteral. Las precauciones para evitar la transmisión parenteral son las mismas que para el VHB. No está indicada la retirada de la lactancia materna.
La Hepatitis E se transmite por alimentos y agua contaminados, al igual que la hepatitis A. Es el responsable de brotes mayores de hepatitis aguda en países en desarrollo, y causa del 10% de casos sospechosos de hepatitis viral aguda, especialmente en África y Asia. Mientras que la Hepatitis G es similar a los VHB y C es transmitida a través de sangre contaminada, y se ha descrito una prevalencia de exposición a la infección en Arabia Saudí de hasta un 4,3%. Las hepatitis B y C suponen una mayor carga sanitaria en términos de mortalidad, ya que pueden causar una infección de por vida (infección crónica) que conduzca eventualmente a la aparición de cirrosis hepática y cáncer. De hecho, la hepatitis crónica es la causa principal de cirrosis hepática y cáncer, han indicado fuentes de la Sociedad Española de Pediatría Extrahospitalaria y Atención Primaria (SEPEAP).

Autor/a: ClkerFreeVectorImages
Fuente: Pixabay / Public Domain
Autorización de comercialización para Grazoprevir/Elbasvir
Por otro lado, la compañía MSD ha anunciado que la Agencia Europea del Medicamento (EMA, por sus siglas en inglés) ha admitido para revisión una solicitud de autorización de comercialización (MAA, por sus siglas en inglés) para grazoprevir/elbasvir (100 mg/50 mg), un régimen de comprimido único diario en investigación para el tratamiento de pacientes adultos con infección crónica por el virus de la hepatitis C (VHC), genotipos (GT) 1, 3, 4 o 6.[1] La EMA iniciará la revisión de la MAA mediante el procedimiento de evaluación acelerado. El proceso de evaluación acelerado de la Agencia Europea del Medicamento está disponible para productos que cubren necesidades médicas aún no satisfechas o que representan una mejora significativa frente a las opciones de tratamiento actuales y que tienen un elevado interés para la salud pública, como el tratamiento de la infección crónica por VHC. El Comité de Medicamentos de Uso Humano (CHMP, por sus siglas en inglés) seguirá valorando el estado de evaluación acelerado a través del proceso de evaluación de la solicitud de autorización de comercialización.
La solicitud de autorización de comercialización para grazoprevir/elbasvir (100mg/50mg) se basa, en parte, en datos procedentes del programa de ensayos clínicos pivotales C-EDGE, así como de los ensayos clínicos C-SURFER, C-SALVAGE y C-SWIFT, que evalúan grazoprevir/elbasvir (100mg/50mg), con o sin ribavirina, en pacientes con infección crónica por VHC. Estos ensayos evalúan, conjuntamente, regímenes de tratamiento en múltiples genotipos (GT 1, 3, 4 y 6), incluidas poblaciones de pacientes previamente tratados y aquellas con cirrosis o determinadas comorbilidades (por ejemplo, co-infección con VIH, enfermedad renal crónica en estadios 4 y 5). La compañía presentó una solicitud de medicamento nuevo para grazoprevir/elbasvir (100mg/50mg) a la FDA de Estados Unidos en mayo de 2015 para el tratamiento de la infección crónica por VHC GT 1, 4 o 6, y presentará solicitudes de licencia adicionales en otros mercados a finales de 2015. En abril de 2015, la FDA otorgó la designación de Terapia Innovadora para grazoprevir/elbasvir para el tratamiento de pacientes con infección crónica por VHC GT1 con enfermedad renal en fase terminal sometidos a hemodiálisis y también designó Terapia Innovadora a grazoprevir/elbasvir para el tratamiento de pacientes con infección crónica por VHC GT4. La designación de Terapia Innovadora está destinada a acelerar el desarrollo y la revisión de una molécula candidata que se pretende usar, sola o en combinación, para tratar enfermedades graves o potencialmente mortales en las que las evidencias clínicas preliminares indiquen que el medicamento podría ser sustancialmente beneficioso en comparación con otros tratamientos existentes en una o más variables de evaluación clínicamente significativas.
Comprimido único en régimen diario
Grazoprevir/elbasvir es una terapia en investigación, consistente en un comprimido único en un régimen diario compuesto por grazoprevir (inhibidor de la proteasa NS3/4A) y elbasvir (inhibidor del complejo de replicación NS5A). Como parte de los amplios programas de ensayos clínicos de MSD, grazoprevir/elbasvir está siendo estudiado en múltiples genotipos del VHC y en pacientes con condiciones de difícil tratamiento como la coinfección con VIH/VHC, enfermedad renal crónica, enfermedades hereditarias de la sangre, cirrosis hepática y aquellas con tratamiento de sustitución de opiáceos.
Referencias
[1] Grazoprevir es un inhibidor de la proteasa NS3/4A del VHC y elbasvir es un inhibidor del complejo de replicación NS5A del VHC.




