1. Introducción
2. Etiopatogenia
3. Factores de Riesgo
4. Tratamiento ITU Recurrente
5. Profilaxis con probióticos
6. Conclusiones
7. Bibliografía
1. Introducción

Dr. Francisco José Brenes
Las infecciones del tracto urinario (ITUs), después de las infecciones respiratorias, son la segunda causa de consulta por patología infecciosa en atención primaria (1,2) . Más del 50% de las mujeres presentarán al menos un episodio de ITU en su vida (2).
Generalmente se trata de ITUs no complicadas. Se considera que una ITU es no complicada cuando se presenta en individuos cuyos mecanismos de defensa se encuentran intactos y con un tracto urinario estructuralmente normal (1).
Dentro de las ITUs no complicadas la más frecuente en la mujer es la cistitis (1). El término cistitis hace referencia a la inflamación de la vejiga urinaria, habitualmente de causa infecciosa. Cursa con disuria, urgencia miccional y polaquiuria y, a veces, dolor suprapúbico (síndrome miccional), habitualmente sin fiebre (3).
Afecta en una mayor proporción a mujeres jóvenes sobre todo activas sexualmente En mujeres postmenopáusicas se relaciona la presencia de cistitis con el déficit estrogénico (atrofia vaginal) y la presencia de otras alteraciones (cistocele, incontinencia urinaria, etc.) (1,2,3).
El tratamiento de las cistitis en la mujer debido a las características generalmente leves y la ausencia de complicaciones suele ser empírico en base a los gérmenes habitualmente aislados y su sensibilidad a la acción de distintos antimicrobianos (1,2). Por lo que periódicamente debemos conocer cuál es en nuestra zona geográfica; la etiología de la ITU no complicada, la resistencia bacteriana y la actividad de los antibióticos, para que pautemos el tratamiento empírico más adecuado (1,3,4).
Aproximadamente un tercio de las mujeres afectas de ITU presentarán recurrencias (2 o > infecciones en 6 meses o 3 o >infecciones en un año) (2,5).
A diferencia de las cistitis aislada cuyo diagnóstico se realiza en base a criterios clínicos (síndrome miccional) y la tira reactiva colorimétrica de orina, las cistitis recurrentes deben diagnosticarse mediante urocultivo (6) y si son muy recidivantes podría ser necesario realizar estudios de las vías urinarias (2,7).
Las cistitis recurrentes requieren una atención especial, se asocian con una considerable morbilidad, alteraciones de la calidad de vida y uso de servicios de salud. Las características clínicas y gérmenes causantes suelen ser similares a los de los casos de cistitis aisladas (1,2,5).
La estrategia terapéutica clásica para su prevención se ha realizado mediante antibióticos (profilaxis antibiótica “continua y postcoital, autotratamiento) (2,5,6). Por lo que es muy importante que consideremos las consecuencias que pueda tener en la flora vaginal y en la aparición de resistencias, el uso de antibióticos durante periodos largos de tiempo.
En la última década se ha avanzado considerablemente en el conocimiento de la patogenia y estrategias de prevención de las ITU recurrentes Por lo que se han añadido otras alternativas terapéuticas como la toma de extractos de arándano rojo americano, lactobacillus de aplicación vaginal, estrógenos tópicos en la atrofia vaginal y más recientemente, las vacunas (2,6).
2. Etiopatogenia
La mayoría de las ITUs se generan por vía ascendente (1). Habitualmente están producidas por microorganismos aerobios gramnegativos procedentes de la zona del colon (enterobacterias), estos gérmenes suelen estar presentes en la zona periuretral y en el introito vaginal.
En España, Escherichia coli (E.coli) es el uropatógeno más frecuente en mujeres de 18 a 65 años (79,2%)(8), seguido a gran distancia por Staphylococcus saprophyticus (4,4%), más aislado en mujeres < 30 años de edad, Proteus mirabilis (4,3%), más aislado en mujeres > 50 años de edad, Enterococcus faecalis (3,2%) y Klebsiella pneumoniae (2,3%).
La ITU es el resultado de la interacción de un germen (patógeno) y el huésped Los gérmenes presentan una serie de características que pueden influir sobre su capacidad infectiva. Aunque esta será más o menos importante dependiendo de la capacidad defensiva que tenga el huésped. En la mujer sana este mecanismo defensivo fundamentalmente se debe a la presencia de lactobacillus, siendo los gérmenes más frecuentes a nivel del introito vaginal, su función defensiva se debe a su capacidad de producir sustancias antimicrobianas como peróxido de hidrógeno (H2O2), que inhibe el crecimiento de los patógenos, a la producción de ácido láctico y surfactantes que impiden la adherencia bacteriana y a la capacidad que tienen los lactobacillus de estimular otras defensas del huésped como citoquinas, macrófagos y leucocitos (9,10,11) (Figura 1).
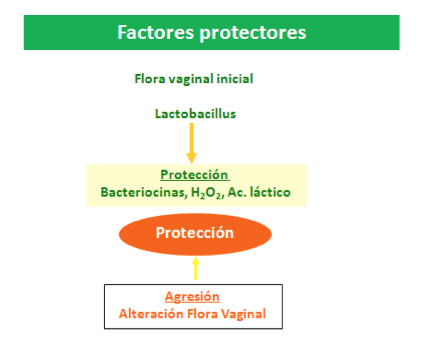
Figura 1. Factores de protección vaginal
En determinadas circunstancias existe una disminución del número de lactobacillus por deficiencia estrogénica, tratamiento antibiótico, uso de espermicidas, etc. Alterándose la capa protectora que estos generan a nivel del tracto urogenital (2,6,11).
Las enterobacterias en una primera fase colonizan el introito vaginal y la región periuretral (1). Un pequeño número de bacterias consigue ascender hasta la vejiga y más excepcionalmente a la pelvis y parénquima renal.
Normalmente estas bacterias son eliminadas por el flujo y las propiedades antibacterianas de la orina, y en menor medida por la presencia de Inmunoglobulina A (IgA) secretora y los escasos polimorfonucleares presentes en la superficie vesical. Si las bacterias no son eliminadas, se inicia una colonización (adhesión del microorganismo al urotelio, reproducción de éste y eliminación por orina) o una infección (implica lesión del epitelio vesical) (1,11).
No todas las cepas de E. coli, poseen la misma capacidad para infectar el aparato urinario. Sólo las cepas con determinado grado de virulencia son capaces de producir una infección en pacientes con el aparato urinario intacto (10,11).
Entre los principales factores de virulencia de la E. coli, destacan (1,11):
· La presencia de adhesinas que permiten su adhesión al urotelio. Se encuentra en unas estructuras alargadas denominadas fimbrias de tipo 1 y P (Figura 2). Los individuos que son colonizados con gérmenes con fimbrias tipo P son más susceptibles de padecer una pielonefritis (10).
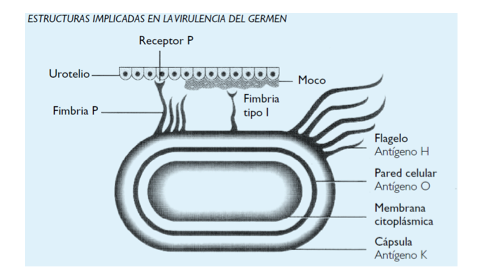
Figura 2. Estructuras de E. coli. (Tomado de cita 10)
· La capacidad de estructurarse en biopelículas.
· La liberación de toxinas (hemolisinas, factor citotóxico necrotizante).
Los serotipos de E coli, más infectivos son los que presentan los antígenos 0 (somático) y K (capsular) (10,11).
La presencia de antígeno 0 le confiere a la bacteria más resistencia a las sustancias bactericidas. El antígeno K le confiere mayor resistencia a la fagocitosis y a la acción del complemento. Otro antígeno H o flagelar permiten la movilidad del germen (10,11).
En España en los últimos años se ha producido un incremento, de ITUs causadas por E.coli productores de BLEEs (betalactamasas de espectro extendido)(1), le confieren resistencia a las cefalosporinas de 3ª generación. El 6,7% de las ITUs comunitarias son causadas por E.coli productor de BLEEs (1).
Los factores de riesgo que predisponen a padecer una infección comunitaria por enterobacterias productoras de BLEEs fueron: la utilización reciente de antibióticos (fundamentalmente cefalosporinas de 3ª generación y las fluorquinolonas), la residencia en un centro sociosanitario, la hospitalización reciente y la edad superior a 65 años(1).
La producción de BLEEs tiene importantes implicaciones clínicas ya que estos gérmenes suelen ser resistentes a múltiples antimicrobianos (entre ellos betalactámicos y fluorquinolonas), lo cual limita las opciones terapéuticas (1).
3. Factores de riesgo
En función de la edad se pueden diferenciar varios factores de riesgo para presentar ITUs recurrentes (2,11) (Tabla 1).
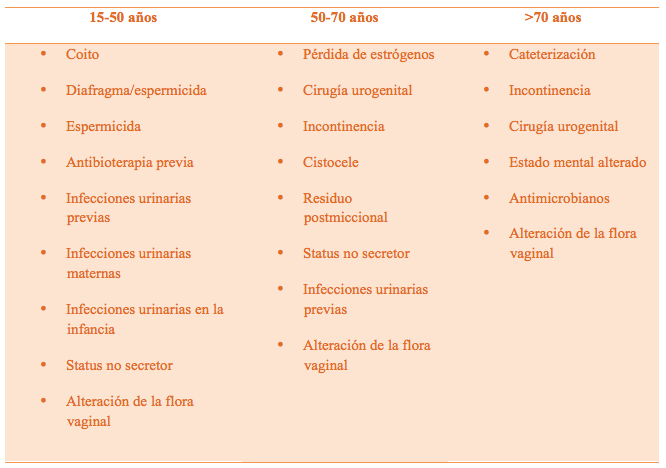
Tabla 1. Factores de riesgo según edad ITUs recurrentes (Tomado de cita 11)
En el intervalo de edad comprendido entre los 15 y los 50 años, los principales factores son; el coito, nueva pareja sexual en el año previo, uso de espermicidas, antibióticoterapia previa, ITU previas, antecedentes de ITU en la infancia e historia de ITU familiar de primer grado en mujeres, la probabilidad de presentar ITU dependerá de diversos factores de riesgo (5,11,12,13) (Tabla 2).

Tabla 2. Factores de riesgo para cistitis recurrente en mujeres jóvenes. (Tomada y adaptada de cita 12)
En estas edades el coito, es el principal factor de riesgo de ITU (1), ya que facilita tanto la colonización periuretral por E. coli como el ascenso del mismo hasta la vejiga. El inicio de la actividad sexual incrementa el riesgo de padecer una ITU en 3,5 veces, posteriormente según la frecuencia de su práctica se dispara desde 0 (no coitos en 7 días) a 2,6 (3 coitos en 7 días) y a 9 veces (7 coitos en7 días) (5,11).
Un estudio realizado con mujeres universitarias con un episodio de cistitis, el 27% presentó al menos una recurrencia en los siguientes seis meses y el 2,7% presentaba una segunda recurrencia durante el mismo período. En un entorno de atención primaria, el 53% de las mujeres mayores de 55 años y el 36% de las mujeres más jóvenes tenían una recurrencia dentro de un año (12,14).
En mujeres postmenopáusicas entre los 50 y 70 años de edad sanas que no sea portadoras de catéter. El factor más predisponente es la disminución de los estrógenos (su déficit aumenta el ph vaginal, disminuyendo la cifra de lactobacillus aumentando la de E coli). Otros factores son; incontinencia urinaria, cirugía urogenital, cistocele, estatus no secretor y la historia de ITU antes de la menopausia (11). En mujeres ancianas institucionalizadas el principal factor de riesgo es el sondaje vesical y el estado funcional del sistema urinario (11).
4. Tratamiento ITU recurrente
En las pacientes jóvenes, en las cuales las ITU suelen estar en relación con la actividad sexual, en pacientes menopáusicas sin patología uroginecológica de riesgo (en las cuales las infecciones se relacionan con un déficit de estrógenos a nivel vaginal), y en las mujeres con patología ginecológica no tributaria de tratamiento quirúrgico (ej.: contraindicación médica) y en los casos en los que persistan las recurrencias, se considerará una de las siguientes estrategias terapéuticas (1,2,5,6): (Tabla 3)
- Profilaxis antibiótica postcoital (Tabla 4)
- Profilaxis antibiótica continua (Tabla 5)
- Aplicación de estrógenos tópicos
- Administración de arándanos
- Probióticos
- Vacunas
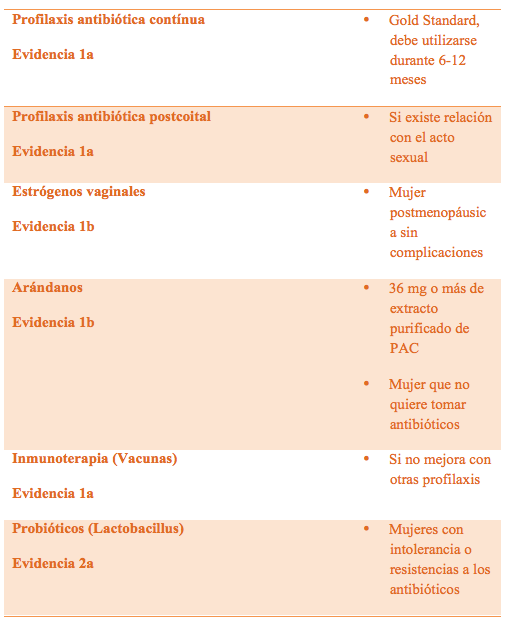
Tabla 3. Posibilidades terapéuticas de las ITUs recurrentes. (Adaptado de citas 2 y 6)
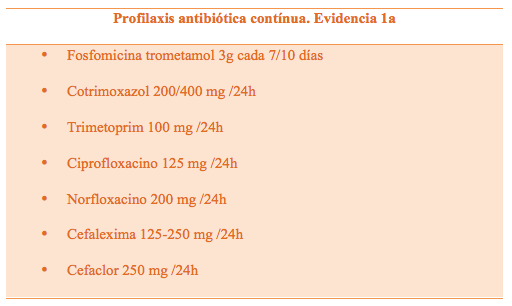
Tabla 4. Pautas más empleadas en la Profilaxis anitibiotica continua (2,5)

Tabla 5. Pautas más empleadas en la Profilaxis antibiótica postcoital (2,5)
Antes de iniciar un régimen profiláctico se ha de confirmar la erradicación de la última cistitis, mediante la realización de un urocultivo 1‑2 semanas después del tratamiento(6)
La decisión de aplicar una u otra estrategia preventiva dependerá de diversos factores tales como la relación de las ITU recurrente con la actividad sexual, los efectos secundarios previos con la toma de antibióticos (ej. candidiasis vaginal), presencia de atrofia vaginal asociada, y dificultades de aplicación y/o efectos secundarios de los estrógenos tópicos (tumefacción mamaria, prurito vaginal, metrorragia). Siempre hay que tener en consideración las preferencias de la mujer (1).
5. Profilaxis con probióticos
En la última década, el uso de probióticos”Lactobacillus” para la prevención de la ITU y restablecer la ecología vaginal está ganando cada vez más aceptación como una alternativa a la terapia antibiótica convencional(2,5,9) con un grado de evidencia IIa (6). Su utilidad reside en la capacidad para mantener el pH vaginal en valores comprendidos entre 4 y 4,5 (9,11).
Las especies que están presentes en la macrobiótica vaginal varían de una mujer premenopáusica a otra postmenopáusica (15). Como se ha comentado antes de la menopausia los Lactobacillus son los microorganismos predominantes en la vagina de la mujer (9,11). Protegen a la vagina frente a la colonización por uropatógenos, interfieren su adherencia al epitelio vaginal bloqueando sus receptores por mecanismos de exclusión o desplazamiento, e inhiben la multiplicación de los uropatógenos mediante la producción y excreción de diversas sustancias como; H2O2, ácido láctico y bacteriocinas (5,9,15).
Se sabe además que los Lactobacillus pueden inducir estrés sobre la membrana externa de E.coli, afectando la estructura de las fimbrias y sobreregulando dos proteínas de la membrana externa, OmpA y OmpX (15). No todas las cepas de Lactobacillus presentan estas características. Un 10% se adhiere al epitelio vaginal (9).
Se han descrito 35 especies de Lactobacillus (9). Cada mujer suele presentar un solo tipo. Los más frecuentes son L iners, L crispatus, L gasseri y L. jensenii, seguidos por L acidophilus, L fermentum, L plantarum, L brevis, L casei, L vaginalis, L delbrueckii, L salivarius, L reuteri, L rhamnosu (9,15).
Se han realizado muy pocos ensayos clínicos con cepas bien caracterizadas, para fines de profilaxis, por lo que tan solo han de utilizarse las cepas de lactobacillus evaluadas mediante estudios específicos (6). Según distintos estudios y diferentes cepas utilizadas, se consigue una reducción de la cistitis que oscila entre el 50-73% (9).
No obstante, existen resultados contradictorios sobre los efectos beneficiosos de probióticos en la profilaxis de las ITU recurrentes. Un estudio realizado por Baerheim y colaboradores (16) en el que se comparaba el uso de óvulos vaginales de L casei y L rhamnosus comparados con placebo no observaron ninguna diferencia en la tasa de ITU de ambos grupos. Sin embargo, otros estudios descriptivos que incluyen un reducido número de pacientes informaron de buenos resultados (17,18).
Se ha demostrado la adherencia in vitro de L crispatus a células del epitelio vaginal humano(19). Y en el año 2011, se ha publicado un estudio aleatorizado en el que se comparaba placebo frente a óvulos vaginales de L crispatus CTV-05. En este estudio se observa que en el grupo de intervención se redujo el riesgo de ITU respecto a placebo, alcanzando un alto nivel de colonización vaginal en la mayoría de las mujeres (20).
Se puede afirmar que la aplicación vaginal de L. crispatus reduce el número de cistitis recurrentes en las mujeres premenopáusicas (grado de evidencia 1b) (6).
La utilización de Lactobacillus en aplicación vaginal es una estrategia profiláctica atrayente, pero los trabajos iniciales parecen indicar que el efecto preventivo es transitorio, por lo que se requieren de más estudios que demuestren su eficacia y inocuidad (15,21).
Un estudio de no inferioridad publicado en el año 2012(22) en el que se compara la administración de trimetropin-sulfametoxazol 480 mg una vez al día o una cápsula oral que contiene 10 (9) UFC de L rhamnosus GR-1 y L reuteri RC-14 dos veces al día. Se observó que Lactobacillus no cumple con los criterios de no inferioridad en la prevención de las ITU en comparación con trimetropin-sulfametoxazol.
En otro estudio anterior (23) en el que se evaluaron las tasas de recurrencia de ITU con una pauta corta de terapia antibiótica (con norfloxacino o trimetropin-sulfametoxazol) seguido de la administración de óvulos vaginales de L rhamnosus GR-1 y L fermentum B-54 o placebo. La tasa de recurrencia de ITU sintomáticas durante 6 meses en el grupo de los antibióticos más Lactobacillus, en comparación con el grupo de antibióticos más placebo, fue del 21% y 47%.
6. Conclusiones
Se puede afirmar, pues, que:
▪ El tratamiento posantibiótico reduce las recidivas en algunos estudios y los resultados son prometedores por lo que respecta a L. crispatus intravaginal, a L. rhamnosus GR-1 oral y a L. reuteri RC-14 oral (21).
▪ En un metaanálisis del año 2013 (24), se aprecian buenos resultados si se utilizaban óvulos vaginales con cepas de L crispatus o una combinación L. rhamnosus GR-1 y L. fermentum B-54 .
▪ En una reciente revisión(25) de 20 estudios, los autores observan que los probióticos son una opción prometedora en la prevención de recurrencias de ITUs y en infecciones vaginales, siendo su uso seguro y coste-efectivo, sobre todo en la población de mayor riesgo.
Por todo esto, el uso de lactobacillus para la prevención de la ITU y para restablecer la ecología vaginal está ganando aceptación como una alternativa a la terapia antibiótica convencional, siendo una opción segura a los antimicrobianos para la profilaxis de ITU en mujeres de alto riesgo sobre todo cuando la resistencia a los antimicrobianos es un problema (2,6,26).
La evidencia de los distintos estudios nos sugiere que los probióticos pueden ser beneficiosos para la prevención de las ITU recurrentes en las mujeres; tienen un buen perfil de seguridad (27). Sin embargo, se requiere más investigación a largo plazo para confirmar estos resultados antes de que el uso generalizado de los probióticos para que esta indicación pueda ser recomendada a toda las mujeres afectas de ITU recurrente sobre todo en mujeres premenopáusicas (9,15,27).
Es necesario profundizar en el conocimiento de las repercusiones de la administración prolongada de Lactobacillus en el tracto urogenital, debemos conocer si se produce algún tipo de efecto adverso, si tienen consecuencias sobre la calidad de vida, cuál es el efecto que producen en la embarazada. En qué momento hay que administrarlos, cuáles son la dosis y el tiempo óptimos de administración, etcétera (21).
En animales de experimentación (ratones hembra endocriados), se ha demostrado que la administración intrauretral de Lactobacillus no produce efectos adversos ni modificaciones estructurales o ultraestructurales, previniendo eficazmente las ITUs (21).
7. Bibliografía
1. Palou J, Millán F, Brenes F J, Costa J. Cistitis no complicada en la mujer. Guía de práctica clínica. Asociación Española de Urología: Actualización 2013
2. Brenes FJ. Cistitis recurrentes en la mujer. 7DM 2014; nº 856: 16-18
3. Horcajada JP. Conducta y tratamiento de la cistitis (Atención Urgente)JANO 13-19 DE ABRIL 2007. N.º 1.64 31-33
4. McIsaac WJ, Moineddin R, Ross S, Validation of a decision aid to assist physicians in reducing unnecessary antibiotic drug use for acute cystitis, Arch Intern Med. 2007; 167: 2201–2206.
5. Pigrau C. Infecciones urinarias recurrentes: Factores predisponentes y estrategias de prevención. En Pigrau C. Infección del tracto urinario. Ed Ergin; 2013: 85-104
6. Grabe M, et al. Guidelines on Urological Infections. European Association of Urology .2014
7. Kodner C M,Thomas Gupton EK. Recurrent Urinary Tract Infections in Women: Diagnosis and Management. Am Fam Physician. 2010 Sep 15;82(6):638-643
8. Palou J, Pigrau C, Molina I, Ledesma JM, Angulo J. Grupo colaborador español del estudio ARESC. Etiología y sensibilidad de los uropatógenos identificados en infecciones urinarias bajas no complicadas de la mujer en España (estudio ARESC) implicaciones en la terapia empírica Med Clin (Barc). 2011;136:1–7
9. Andreu A. Patogenia de las infecciones urinarias. En: C. Pigrau. Infección del tracto urinario. Ed Ergon 2013:85-104. ISBN:976-84-15351-63-4.
10. Brenes FJ. Generalidades de las ITUs. En Brenes FJ. Manual de evaluación diagnóstica y terapéutica de las infecciones del tracto urinario (ITUs). Abordaje desde la Atención Primaria. IMC. 2003; 12-20
11. Andreu A. Patogenia de las infecciones del tracto urinario. Enferm Infecc Microbiol Clin.2005;23(4).15-21
12. Kodner C M,Thomas Gupton EK. Recurrent Urinary Tract Infections in Women: Diagnosis and Management. Am Fam Physician. 2010 Sep 15;82(6):638-643
13. Scholes D, Hooton TM, Roberts PL, Stapleton AE, Gupta K, Stamm WE. Risk factors for recurrent urinary tract infection in young women. J Infect Dis. 2000;182(4):1177–1182
14. Foxman B. Recurring urinary tract infection: incidence and risk factors. Am J Public Health. 1990;80(3):331–333
15. Jiménez-Pacheco Antonio, Jiménez-Pacheco Araceli. El uso de probióticos como alternativa en la prevención de las infecciones urinarias recurrentes en mujeres .Rev Med Chile 2013; 141: 809-810
16. Baerheim A, Larsen E, Digranes A. Vaginal application of lactobacilli in the prophylaxis of recurrent lower urinary tract infection in women. Scand J Prim Health Care 1994; 12: 239-43
17. Bruce A W, Reid G. Intravaginal instillation of lactobacilli for prevention of recurrent urinary tract infections. Can J Microbiol 1988; 34: 339-43.
18. Uehara S, Monden K, Nomoto K, Seno Y. Kariyama R, Kumon H. A pilot study evaluating the safety and effectiveness of Lactobacillus vaginal suppositories in patients with recurrent urinary tract infection. Int J Antimicrob Agents 2006; 28 Suppl 1: 30-34
19. Kwok L, Stapleton A E, Stamm W E, Hillier S L, Wobbe C L, Gupta K. Adherence of Lactobacillus crispatus to vaginal epithelial cells from women with and without a history of recurrent urinary tract infection. J Urol 2006; 176: 2050-4
20. Stapleton AE, Au-Yeung M, Hooton TM, Fredricks DN, Roberts PL, Czaja CA, et al. Randomized, placebo-con-trolled phase 2 trial of a Lactobacillus crispatus probiotic given intravaginally for prevention of recurrent urinary tract infection. Clin Infect Dis 2011; 52 (10): 1212-7
21. Nader-Macías ME. Bacterioterapia con lactobacilos probióticos para la prevención de infecciones urogenitales. Trabajos Distinguidos Urología 6(5):4-7, Mar 2014
22. Beerepoot MA, ter Riet G, Nys S, van der Wal WM, de Borgie CA, de Reijke TM, et al. Lactobacilli vs antibiotics to prevent urinary tract infections: a randomized, double-blind, noninferiority trial in postmenopausal women. Arch Intern Med2012; 172 (9): 704-12.
23. Reid G, Bruce AW, Taylor M. Influence of three-day antimicrobial therapy and lactobacillus vaginal suppositories on recurrence of urinary tract infections. Clin Ther 1992; 14 (1): 11-6.
24. Grin PM, Kowalewska PM, Alhazzani W, Fox-Robichaud AE . Lactobacillus for preventing recurrent urinary tract infection in women: meta-analysis. The Canadian Journal of Urology 2013, 20(1): 6607-6614.
25. Urrútia G, Selva A, Calaf JRevisión de la evidencia sobre la eficacia de los probióticos en la prevención de las infecciones del tracto urinario inferior y las infecciones vaginales. Progresos de Obstetricia y Ginecología. 2014;57(5):230-235.
26. Chisolm A H. Probiotics in Preventing Recurrent Urinary Tract Infections in Women: A Literature Review. Urol Nurs.2015;35(1):18-21
27. Falagas ME et al. Probiotics for prevention of recurrent urinary tract infections in women: a review of the evidence from microbiological and clinical studies. Drugs. 2006;66(9):1253-61.




