1. Introducción
2. Evidencias preclínicas en vaginosis
3. Evidencias clínicas en vaginosis
4. Conclusiones
5. Bibliografía
1. Introducción

Dra. Ana Rosa Jurado
La vaginosis bacteriana (VB) es una de las infecciones más frecuentes de tracto urogenital de las mujeres sexualmente activas (1). Es considerada como patología infecciosa endógena, que se debe a la proliferación desordenada de la microbiota como consecuencia de la ruptura del equilibrio vaginal (2).
En este proceso, los lactobacilos productores de H2O2 dominantes en la vagina son sustituidos por microorganismos como Gadnerella vaginalis y otros anerobios (Bacteriodes spp, Peptostreptococcus spp, Prevotella spp, Mobiluncus spp, Mycoplasma hominis, Prophyromonas spp, Atopium vaginae…) (3,4)
Provoca un flujo vaginal anormal, abundante, generalmente referido por la paciente con “mal olor”, pero sin inflamación, es decir, frecuentemente cursa sin sintomatología pruriginosa o irritativa(4). Los criterios clínicos que la diferencian del resto de las vaginitis aparecen en la Tabla 1 del Tema 2 (2).
Para el diagnóstico de VB se utilizan los criterios de Amsel (5) (Tabla 1), cuando se presentan al menos 3 de los 4, y/o el sistema Nugent (6) (Tabla 2), que cuenta la proporción de lactobacilos, Gadnerella y otros morfotipos en tinción de gram por campo de gran aumento. En la actualidad se considera que el criterio con mayor sensibilidad y especificidad para el screning sería la presencia de células clave o “clue cells”, y que la confirmación vendría dada por un valor Nugent ≥7 (7).

Tabla 1. Criterios de Amsel para el diagnóstico de la Vaginosis Bacteriana (5). Se necesita la presencia de al menos 3 de los 4 criterios.

Tabla 2. Sistema Nugent para diagnóstico de Vaginosis Bacteriana (6,7).
Aunque no se considera una infección de transmisión sexual (ITS), se produce sobre todo en mujeres sexualmente activas, y cada vez hay más pruebas de la asociación entre VB e ITS:
- Mayor riesgo de transmisión y contagio del VIH (8).
- Estado de portador de Neisseria gonorrhoeae y Chlamydia trachomatis (9).
- Factor de infección por el virus del herpes simple tipo 2 (10).
- Aumenta el riesgo de contagio o reactivación de algunos subtipos del virus del papiloma humano (VPH) (11) y la persistencia de infección (12).
También existen pruebas de la relación entre la VB y determinadas complicaciones ginecológicas y obstétricas (13,14,15):
- Enfermedad Inflamatoria Pélvica (EPI) e infertilidad por factor tubárico.
- Complicaciones en embarazo: aborto espontáneo tardío, corioamnionitis, rotura prematura de mebranas, parto prematuro, endometritis postparto.
- Menores tasas de implantación y mayores de pérdida de temprana de embarazo en técnicas de fecundación in vitro (FIV).
Ante estos hechos, las guías ginecológicas actuales recomiendan el tratamiento de la VB en las siguientes ocasiones (16,17):
- Pacientes sintomáticas
- Previo a procedimientos ginecológicos invasivos
- Gestantes sintomáticas y en asintomáticas con antecedentes de parto prematuro
- Pareja sexual si hay balanitis o vaginosis de repetición
El tratamiento de la VB se hace con antibióticos como Metronidazol o Clindamicina, vía oral o vaginal (Tabla 3) (16,17). La respuesta es adecuada, aunque hasta el 15% de las mujeres pueden no responder, según las series. El principal problema deriva de las recurrencias, que afectan al 80% de los casos, requieren nueva administración de antibióticos y pueden generar resistencias y alteraciones de la microbiota, que a su vez predisponen a la aparición de candidiasis y vaginosis.
Este hecho ha determinado la búsqueda de alternativas y/o complementos para los tratamientos actuales, de entre los cuales los probióticos (productos con lactobacilos) son los más investigados y postulados. Teniendo en cuenta la fisopatología de la VB, es lógico pensar que la suplementación con lactobacilos puede ser la clave para el reestablecimiento del equilibrio vaginal, la reducción de las recidivas y/o el alargamiento del tiempo libre de enfermedad.
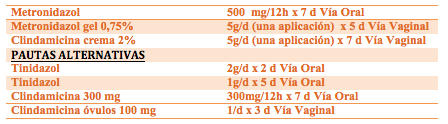
Tabla 3. Pautas recomendadas para el tratamiento de la VB y pautas alternativas (16,17).
2. Evidencias preclínicas en la vaginosis bacteriana
Los estudios preclínicos, in vitro y en modelos animales, han sido capaces de determinar la eficacia de Lactobacillus spp frente a patógenos vaginales como Gadnerella vaginalis y otros microorganismos involucrados en la VB (Prevotella bivia, etc) (18,19,20,21). También se ha comprobado su efecto frente a Streptococo grupo B, E. coli, Neisseria gonorrhoeae, Staphylococcus aureus y Trichomonas vaginalis (18,22,28).
Son numerosas las cepas de lactobacilos evaluadas: L gasseri, L acidophilus, L reuteri, L rhamnosus, L paracasei, L plantarum, etc (18-22,24,26,27,29) y algunos de ellos en asociación.
También se dilucidan en ensayos in vitro los principales mecanismos de acción de los lactobacilos frente a los microorganismos que se encuentran en la VB:
- Adherencia a células epiteliales, tanto cervicales como vaginales (18-22, 28-30) y autoagregación (29).
- Producción de ácido láctico (24,25).
- Producción de peróxido de hidrógeno (19,20,31,32).
- Producción de bacteriocinas (33,34,35).
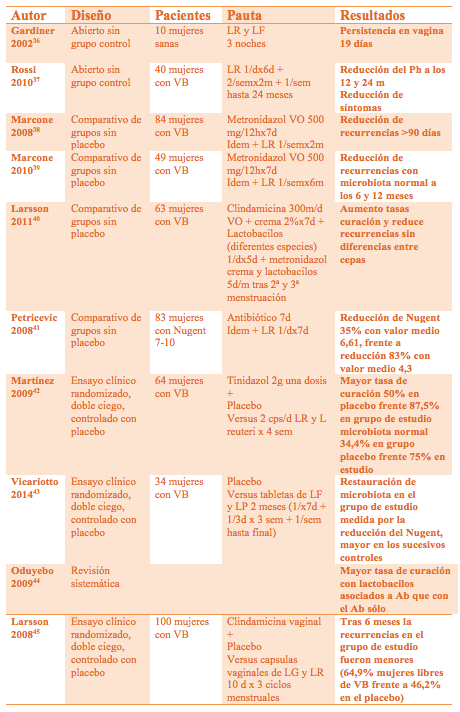
Tabla 4. Estudios clínicos más relevantes que evidencia la eficacia de los probióticos administrados vía vaginal sobre la VB. (LR: Lactobacillus rhamnosus; LF: Lactobacillus Fermentum; LP: Lactobacillus plantarum; LG: Lactobacillus Gasseri)
3. Evidencias clínicas en la vaginosis bacteriana. (Tabla 4)
En diferentes ensayos clínicos se ha podido comprobar como los productos probióticos que contienen lactobacilos son capaces de persistir en la vagina de las pacientes durante 5-19 días, tras ser insertados en forma de cápsulas vaginales durante tan sólo 3 noches (36); o de mantener la reducción del Ph tras ser utilizados como único tratamiento en pautas crónicas en mujeres con VB (37).
Varias cepas de lactobacilos utilizados vía vaginal en mujeres con VB han mostrado su eficacia en la reducción de los síntomas, incluso administrados como tratamiento único (37), así como en la reducción de las recurrencias cuando se utiliza de coadyuvante al tratamiento antibiótico (38,39,40). La asociación de tabletas vaginales con lactobacilos, una vez a la semana durante 8 semanas, al tratamiento con Metronidazol oral, es más eficaz que el antibiótico sólo, manteniendo a las pacientes libres de recurrencias más allá de los 90 días post intervención. Si se extiende la suplementación a los 6 meses se consiguen 6-12 meses de normalidad en la microbiota bacteriana en un elevado porcentaje de las mujeres (38,39).
En ensayos diseñados con placebo, donde se compara el tratamiento antibiótico en mujeres con VB, con y sin asociación de lactobacilos vía vaginal, se obtienen resultados favorables para dicha asociación: reducción de Nugent en el 35% de las mujeres, frente al 83% en el grupo con lactobacilos (41); tasas de curación del 50% frente al 87,5% y normalización de la microbiota en el 34,4% frente al 75% en el grupo de estudio (42).
Un reciente estudio piloto evalúa la aplicación de tabletas vaginales con L fermentum y L platarum frente a placebo, en mujeres diagnosticadas con VB. Durante los primeros 7 días se aplican las tabletas diariamente, después una vez cada 3 días durante 3 semanas y posteriormente una vez a la semana hasta completar dos meses. A pesar de no usar ningún tratamiento antibiótico, se comprueba una restauración de la microbiota mediante la reducción del Nugent, mayor en los sucesivos controles (43).
Para finalizar podríamos señalar que en revisiones sistemáticas se concluye que la asociación a los antibióticos de productos con latobacilos mejora las tasas de curación de la VB, con el mayor nivel de evidencia científica (2,44), y en ensayos clínicos randomizados, doble ciego y controlados con placebo se obtienen elevadas tasas de disminución de las recurrencias de esta afección en las mujeres de los grupos de estudio frente a las incluidas en el placebo (2,42,43,45).
En cuanto a la dosificación y pautas (2,16,46), si bien no están perfectamente establecidas, existen una serie de recomendaciones basadas en los trabajos que más efectividad han demostrado. Si los probióticos son administrados vía oral, se necesita una concentración de lactobacilos de 10(9) unidades formadoras de colonias (UFC) en las cápsulas, y si lo son por vía vaginal al menos 10 (8) UFC/ml. En general se acepta su uso:
- Tras tratamientos antibióticos de la VB, es decir, como suplemento, pasados 2-3 días de finalizado el mismo.
- Con un curso inicial de 5-10 días en el que la suplementación con lactobacilos es diaria. Si se utiliza la vía oral pueden necesitarse más días (15-30).
- Con tendencia a prolongarse en el tiempo mediante un tratamiento de continuidad
Para el tratamiento de continuidad se proponen: 1-2 veces a la semana durante varias semanas (4-10), o repetición mensual de la pauta inicial después o durante la menstruación. Esta última propuesta se basa en los cambios de Ph y por consiguiente de la microbiota, que de forma natural se producen en la vagina de las mujeres en edad fértil, y que son debidos a los cambios fisiológicos hormonales.
Paciente con vaginosis
Fuente: Dra. Ana Rosa Jurado
4. Conclusiones
▪ La VB es una de las afecciones vaginales más frecuentes en la práctica clínica. La elevada tasa de recurrencia y resistencia a los tratamientos antibióticos, así como su fuerte asociación a complicaciones obstétricas y ginecológicas y a la presencia de ITS, llevan a la búsqueda de posibles soluciones para esta patología.
▪ La evidencia científica refrenda el uso de productos probióticos conteniendo lactobacilos como suplemento de los tratamientos específicos en mujeres con vaginosis bacteriana. Se ha demostrado que esta práctica incrementa las tasas de curación y disminuye las recidivas de la vaginosis. De hecho, las más actuales guías recomiendan la prescripción de probióticos, 2-3 días después de finalizado el antibiótico, para mejorar la tasa de curación, y la extensión de su uso en una pauta continua para reducir las recidivas.
5. Bibliografía
1. Jurado AR, Allué J, Pérez S. Retrato de un probiótico. Noticias Méidcas. 2010. 16-30 Junio: 3960.
2. Beltrán Vaquero DA, Guerra Guirao JA. Consenso en probióticos vaginales. AEEM. Ed: EDIMSA. 2012.
3. Quan M. Vaginitis: diagnosis and management. Postgrad Med. 2010 Nov; 122(6):117-27
4. Biggs WS, Williams RM. Common gynecologic infections. Prim Care. 2019 Mar;36(1):33-51, viii
5. Amsel R, Totten PA, Spiegel CA, Chen KC, Eschenbach D, Holmes kk. Nonspecific vaginitis. Diagnosis criteria and microbial and epidemiologic associations. Am J Med. 1983 Jan; 74(1):14-22
6. Nugent RP, Krohn MA, Hillier SL. Reliability of diagnosing bacterial vaginosis is improved by a standardiezed method of gram stain interpretation. J Clin Microbiol. 1991 Feb;29(2):297-301
7. Rodrigues FS, Peixoto S, Adami F, Alves BD, de Sousa Gehrke F, Azzalis LA, de Campos Junqueira VB, Fonseca FL. Proposal of a new cutoff for Nugent criteria in the diagnosis of bacterial vaginosis. J Microbiol Methods. 2015 May 7;115:144-146.
8. Buve A, Jespers V, Crucitti T, Fichorova RN. The vaginal microbiota and susceptibilit to HIV. AIDS, 2014 Oct 23;28(16):2333-44
9. Wiesenfeld HC, Hillier SL, Krohn MA, Landers DV, Sweet RL. Bacterial vaginosis is a strong predictor of Neisseria gonorrhoeae and Chlamdia trachomatis infection. Clin Infect Dis, 2003 Mar 1;36(5):663-8
10. Cherpes TL, Melan MA, Kant JA, Consentino LA, Meyn LA, Hillier SL. Genital tract shedding of herpes simplex virus type 2 in women: effects of hormonal contraception, bacterial vaginosis and vaginal group B Streptococcus colonization. Clin Infect Dis, 2005 May 15;40(10):1422-8
11. De Silva CS, Adad SJ, Hazarabedian de Souza MA, Macedo Barcelos AC, Sarreta Terra AP, Murta EF. Increased frecuency of bacterial vaginosis and Chlamydia trachomatis in pregnant women with human papillomavirus infection. Gynecol Obstet Invest, 2004;58(4):189-93.
12. Gui YL, You K, Qiao J, Zhao YM, Geng L. Bacterial vaginosis is conductive to the presistence of HPV infection. Int J STD AIDS, 2012 Aug;23(8):581-4
13. Wilson JD, Ralph SG, Rutherford AJ. Rates of bacetrial vaginosis in women undergoing in vitro fertilization for different tpes of infertility. BJOG, 2002 Jun;109(6): 714-7
14. Marrazzo JM. Evolving issues in understanding and treating bacterial vaginosis. Expert Rev Anti Infect Ther, 2004 Dec;2(6):913-22
15. Eckert LO, Moore DE, Patton DL, Agnew KJ, Eschenbach DA, Relationship of vaginal bacteria and inflamation with conception and early pregancy loss following in-vitro fertilization. Infect Dis Obstet Gynecol, 2003;11(1):11-7
16. Diagnóstico y tratamiento de las infeciones vulvovaginales. Sociedad Española de Ginecología y Obstetricia. Protocolo actualizado en 2012. Ed: Equium SL
17. Workowski K, Berman S. Sexually Transmitted Diseases Treatment Guidelines, 2010 (CDC). Morbidity and Mortality Weekly Report 2010;59:1-116
18. Boris S, Suárez JE, Vázquez F, Barbés C. Adherence of human vaginal lactobacilli to vaginal epithelial cells and interaction with uropathogens. Infect Immun. 1998 May; 66 (5): 1985-9
19. Mastromarino P, Brigidi P, Macchia S, Maggi L, Pivorano F, Trinchieri V, Conte U, Matteuzzi D. Characterization and selection of vaginal Lactobacillus strains for the preparation of vaginal tablets. J Appl Microbiol. 2002; 93 (5): 884-93
20. Atassi F, Brassart D, Grob P, Graf F, Servin AL. Lactobaillus strains isolated from the vaginal microbiota of healthy women inhibit Prevotella bivia And Gadnerella vaginalis in coculture and cell culture. FEMS Immunol Med Microbiol. 2006 Dec; 48 (3): 424-32
21. Coudeyras S, Jugie G, Vermerie M, Forestier C. Adhesion of human probiotic Lactobacillus rhamnosus to cervical and vaginal cells and interaction with vaginosis-associated pathogens. Infect Dis Obstet Gynecol. 2008; 2008: 549640 Epub 2009 Jan 27
22. Zárate G, Nader-Macias ME. Influence of probiotic vaginal lactobacilli on in vitro adhesion of urogenital pathogens to vaginal epithelial cells. Lett Appl Microbiol. 2006 Aug; 43 (2): 174-80
23. Voravuthikunchai SP, Bilasoi S, Supamala O. Antagonistic activity against pathogenic bacteria by human vaginal lactobacilli. Anaerobe. 2006 Oct-Dec; 12 (5-6): 221-6. Epub 2006 Aug 23
24. Juárez Tomás MS, Ocaña VS, Wiese B, Nader-Macías ME. Growth and lactic acid production by vaginal Lactobacillus acidophillus CRL1259, and inhibition of uropathogenic Escherichia coli. J Med Microbiol. 2003 Dec; 52 (Pt 12): 1117-24
25. Ogawa M, Shimizu K, Nomoto K, Tanaka R, Hamabata T, Yamasaki S, Takeda T, Takeda Y. Inhibition of in vitro qrowth of Shiga toxin-producing Escherichia coli 0157:H7 by probiotic Lactobacillus strains due to production of lactic acid. Int J Food Microbiol. 2001 Aug 15; 68 (1-2): 135-40
26. Vielfort K, Sjölinder H, Roos S, Jonsson H, Aro H. Adherence of clinically isolated lactobacilli to human cervical cells in comptetition with Neisseria gonorrhoeae. Microbes Infect. 2008 Oct; 10 (12-13): 1325-34. Epub 2008 Aug 9
27. Liu H, Gao Y, Yu LR, Jones RC, Elkins CA, Hart ME. Inhibition of Staphylococcus aureus by lysostaphin-expressing Lactobacillus plantarum WCFS1 in a modified genital tract secretion medium. Appl Environ Microbiol. 2001 Dec;77(24):8500-8
28. Phukan N, Parsamand T, Brooks AE, Nguyen TN, Simoes-Barbosa A. The adherente of Trichomoas vaginalis to host ectocervical cells is influenced by lactobacilli. Sex Transm Infect. 2003 Sep;89(6):455-9
29. Malik S, Petrova MI, Claes IJ, Verhoeven TL, Busschaert P, Vaneechoutte M, Lievens B, Lambrichts I, Siezen RJ, Balzarini J, Vanderleyden J, Lebeer S. The highly autoaggregative and adhesive phenotype of the vaginal Lactobacillus plantarum strain CMPG5300 is sortase dependent. Appl Environ Microbiol. 2013 Aug;79(15):4576-85
30. Ocaña V, Nader-Macías ME. Adhesion of Lactobacillus vaginal strains with probiotics porperties to vaginal epithelial cells. Biocell. 2001 Dec; 25 (3): 265-73
31. Pascual LM, Daniele MB, Pájaro C, Barberis L. Lactobacillus species isolated from the vagina: identification, hydrogen peroxide production and nonoxynol-9 resistance. Contraception. 2006 Jan; 73 (1): 78-81. Epub 2005 Nov 16.
32. Vallor AC, Antonio MA, Hawes SE, Hillier SL. Factors associated with acquisition of, or persistent colonization by, vaginal lactobacilli: role of hydrogen peroxide production. J Infect Dis. 2001 Dec 1; 184 (11): 1431-6. Epub 2001 Oct 30
33. Ruiz FO, Gerbaldo G, Asurmendi P, Pascual LM, Giordano W, Barberis IL. Antimicrobial activity, inhibition of urogenital pathogens, and synergistic interactions between lactobacillus strains. Curr Microbiol. 2009 Nov; 59 (5): 497-501
34. Voravuthikunchai SP, Bilasoi S, Supamala O. Antagonistic activity against pathogenic bacteria by human vaginal lactobacilli. Anaerobe. 2006 Oct-Dec; 12 (5-6): 221-6. Epub 2006 Aug 23
35. Eijsink VG, Axelsson L, DiepDB, Havarstein LS, Holo H, Nes IF. Production of class II bacteriocins by lactic acid bacteria; an example of biological warfare and comunication. Antonie Van Leeuwenhoek. 2002 Aug; 81 (1-4): 639-54
36. Gardiner GE, Heinemann C, Bruce AW, Beuerman D, Reid G. Persistence of Lactobacillus fermentum RC-14 and Lactobacillus rhamnosus GR-1 but not L rhamnosus GG in the human vagina as demostrated by randomly amplified polimorphic DNA. Clin Diagn Lab Immunol. 2002 Jan;9(1):92-6
37. Rossi A, Rossi T, Bertini M, Caccia G. The use of Lactobacillus rhamnosus in the therapy of vaterial vaginosis. Evaluation of clinica efficacy in a population of 40 women treated for 24 months. Arc Gynecol Obstet. 2010 Jun;281(6):1065-9. Epub 2009 Dec 12
38. Marcone V, Calzolari E, Bertini M. Effectiveness of vaginal administration of Lactobacillus rhamnosus following conventional metronidazole therapy: how to lower the rate of bacterial vaginosis recurrences. New Microbiol. 2008 Jul;31(3):429-33
39. Marcone V, Rocca G, Lichtner M, Calzolari E. Long-term vaginal administration of Lactobacillus rhamnosus as a complementary approach to management of bacterial vaginosis. Int J Gynaecol Obstet. 2010 Sep;110(3):223-6. Epub 2010 Jun 22
40. Larsson PG, Brandsborg E, Forsum U, Pendharkar S, Krogh-Andersen K, Nasic S, Hammarstrom L, Marcotte H. Extended antimicrobial treatment of bacterial vaginosis combined with human lactobacilli to find the best treatment and minimize the risk of relapses. BMC Infect Dis. 2011; 11: 223
41. Petricevic L, Witt A. The role of Lactobacillus casei rhamnosus Lcr35 in restoring the normal vaginal flora after antibiotics treatment of bacterial vaginosis. BJOG. 2008 Oct;115(11):1369-74
42. Martinez RC, Franceschini SA, Patta MC, Quintana SM, Gomes BC, De Martinis EC, Reid G. Improved cure of bacterial vaginosis with single dose of tinidazole (2g), Lactobacillus rhamnosus GR-1, and Lactobacillus reuteri RC-14: a ramdomized, double-blind, placebo-controlled trial. Can J Microbiol. 2009 Feb;55(2):133-8
43. Vicariotto F, Mogna L, Del Piano M. Effectiveness of the two microorganisms Lactobaillus fermentum LF15 and Lactobacillus plantarum LP01, formulated in slow-release vaginal tablets, in women affected by bacterial vaginosis: a pilot study. J Clin Gastroenterol. 2014 Nov-Dec;48 Suppl 1
44. Oduyebo OO, Anorlu RI, Ogunsola FT. The effects of antimicrobial therapy on bacterial vaginosis in non-pregnant women. Cochrane Database of Systematic Reviews. 2009, Issue 3. Art. No.: CD006055
45. Larsson PG, Stray-Pedersen B, Ryttig KR, Larsen S. Human lactobacilli as supplementation of clindamycin to patienes with bacterial vaginosis reduce the recurrence rate: a 6-month, double-blind, randomized, placebo-controlled study. BMC Womens Health. 2008 Jan 15:8:3
46. Khani S, Hosseini HM, Taheri M, Nourani MR, Imani Fooladi AA, Probiotics as an Alternative Strategy for Prevention and Treatment of Human Diseases: A Review. Inflamm Allergy Drug Targets. 2012 Apr; 11(2):79-89




