
Dr. Fernando A. Moraga Llop
Introducción
En la historia de los calendarios de vacunación pediátrica publicados por el Consejo Interterritorial del Sistema Nacional de Salud, iniciada en 1995, el calendario de 2015 destacará por la incorporación de una nueva vacuna, la antineumocócica conjugada a los 2, 4 y 12-15 meses de edad, cumpliendo el deseo manifestado y exigido repetidamente por los pediatras desde 2003 a través del calendario elaborado por el Comité Asesor de Vacunas de la Asociación Española de Pediatría. Entonces, hace ya 12 años, dicho comité recomendaba la vacuna heptavalente (VNC7v), comercializada en España en junio de 2001, la única conjugada disponible en aquellos momentos, y ahora lo hace con la tridecavalente (VNC13v), comercializada en junio de 2010, debido a las características epidemiológicas de las enfermedades neumocócicas en España, frente a la otra existente, la decavalente.
Además, hay que destacar que la VNC13v alcanzará este año su máximo espectro de edad y preventivo, ya que además de ser una vacuna para todas las edades, desde el lactante hasta cualquier edad adulta, ha demostrado su capacidad preventiva más allá de la enfermedad invasiva en el adulto, incluyendo también la neumonía no bacteriémica, después de haberse presentado los resultados del ensayo clínico realizado en Holanda (estudio CAPITA).
La enfermedad neumocócica en el niño
La neumonía por Streptococcus pneumoniae es la primera causa de muerte por enfermedades inmunoprevenibles en los niños menores de 5 años en todo el mundo (de 1 a 59 meses de edad), por delante de la diarrea por rotavirus, el sarampión y la tos ferina. En el año 2013 causó entre 681.000 y 923.000 fallecimientos, el 22% de la mortalidad total en este periodo de la vida (1).
Las infecciones neumocócicas han experimentado durante los últimos 15 años cambios importantes, además de su prevención mediante la administración de vacunas conjugadas. Esta patomorfosis de las enfermedades neumocócicas ha afectado a la bacteriología del neumococo, y a la clínica, el diagnóstico, el tratamiento y la epidemiología.
En la bacteriología se han producido cambios en el número de serotipos identificados. En estos últimos años se han descrito tres nuevos serotipos: el 6C, el 6D y el 11E; en este momento, podemos afirmar la existencia de más de 93 serotipos.
En el aspecto clínico hay que señalar el aumento de la incidencia de algunas formas clínicas: en primer lugar, las neumonías, algunas veces bilaterales (Figura 1), y especialmente las formas complicadas con derrame pleural, sobre todo del tipo del empiema y las formas necrotizantes (Figura 2 y 3); y en segundo lugar, la aparición de mastoiditis, una afección que parecía ya olvidada, y además a veces con complicaciones intracraneales.
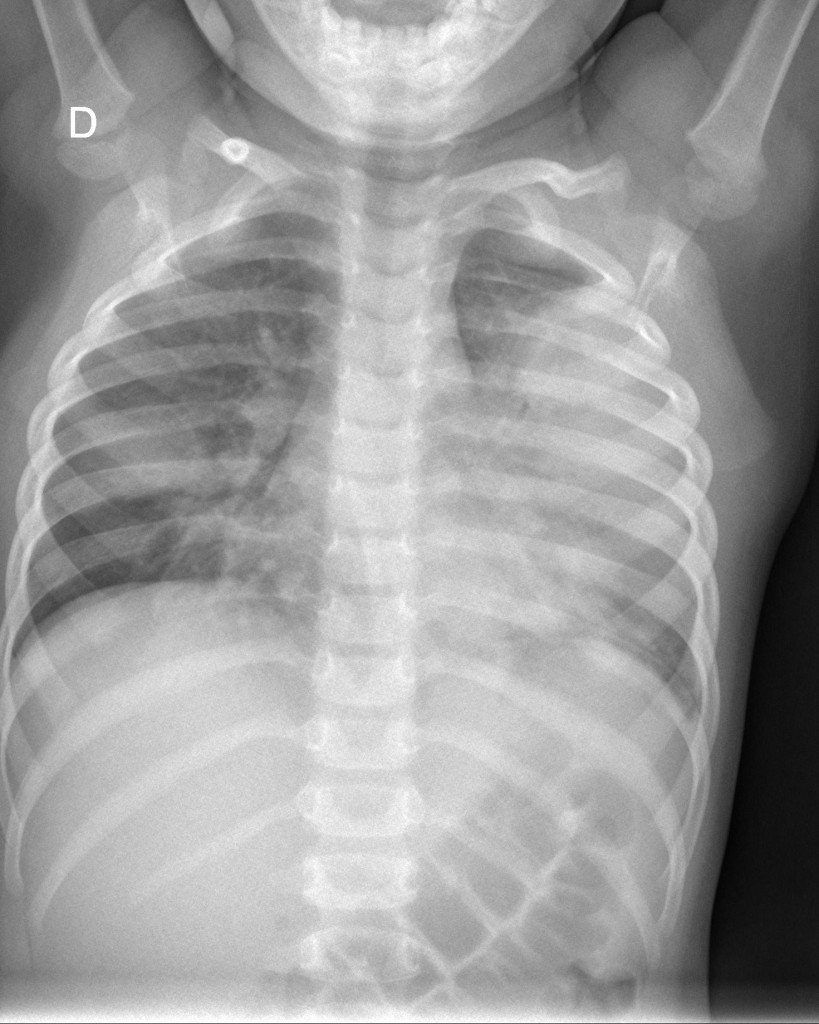
Figura 1
Neumonía bilateral bacteriémica neumocócica por el serotipo 1.
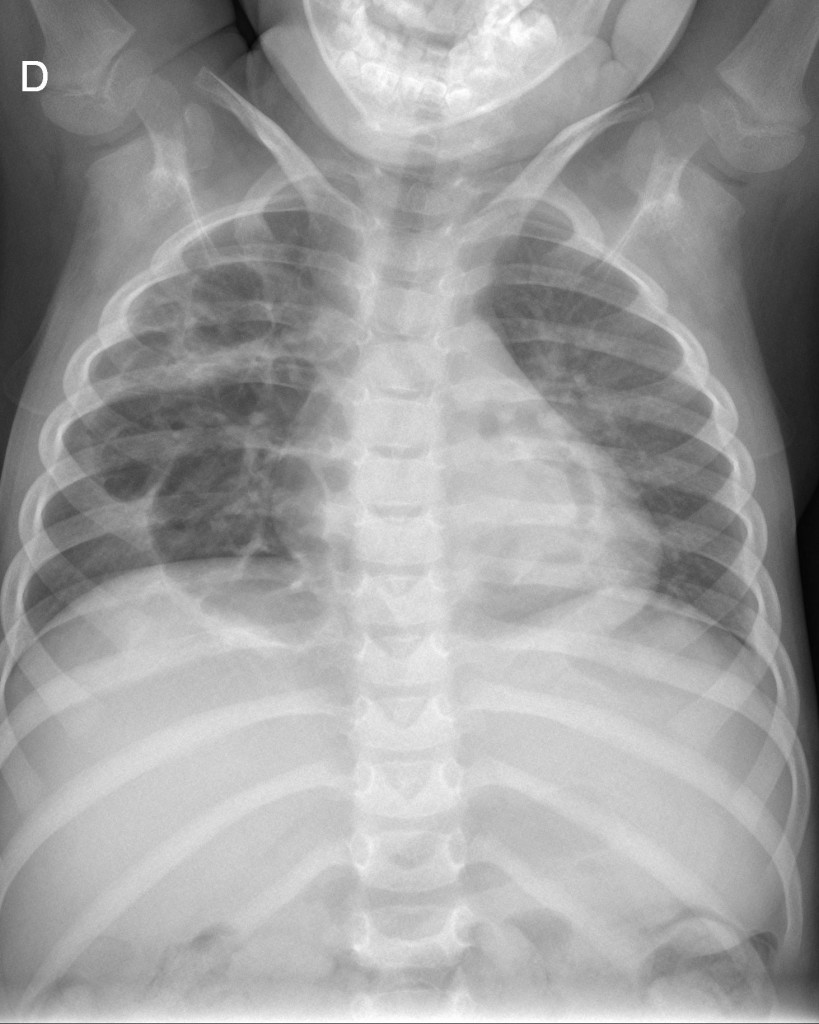
Figura 2
Secuelas al alta en un paciente asintomático diagnosticado de neumonía necrosante bilateral neumocócica por el serotipo 3.
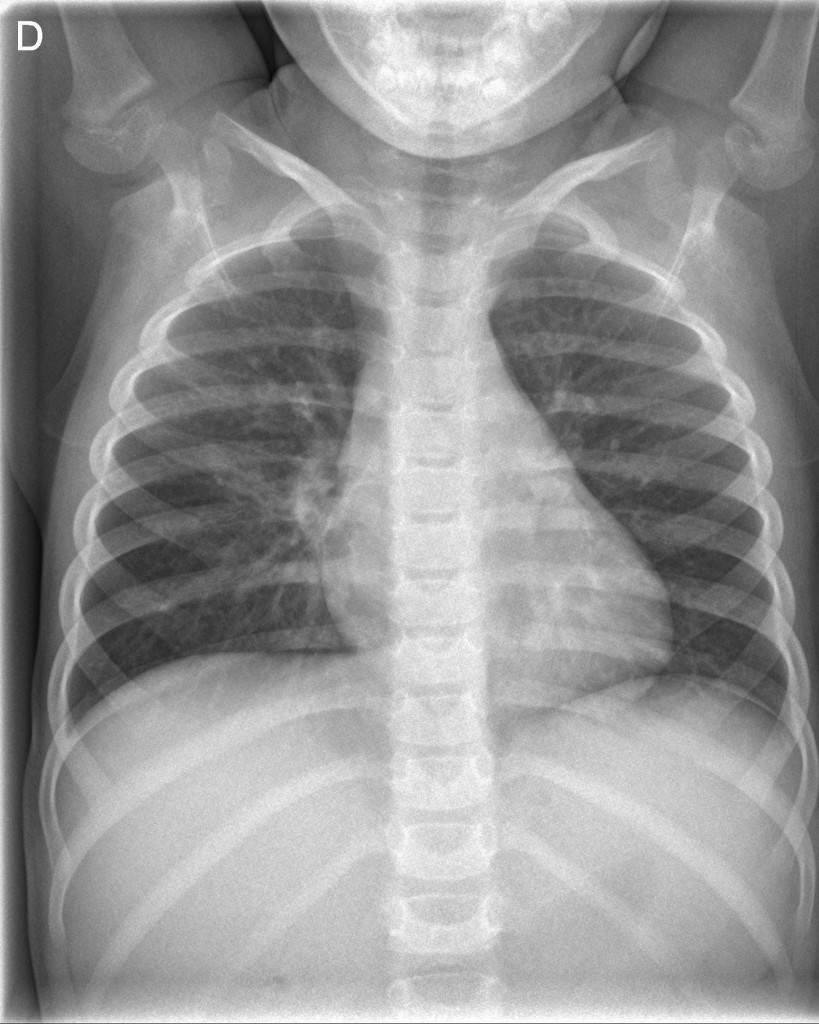
Figura 3
En el mismo paciente de la figura 2, a los 2 meses del alta la radiografía de tórax se había normalizado casi por completo.
En el diagnóstico por la imagen cabe destacar los siguientes avances: la ecografía torácica, que ha sustituido a la radiografía de tórax en decúbito lateral para el estudio del derrame pleural, ya que precisa mejor la cantidad, la localización y las características del líquido pleural; la tomografía computarizada (TC) torácica helicoidal con contraste intravenoso, que sólo se realizará excepcionalmente en la pleuroneumonía de mala evolución y en los casos en que la radiografía simple no ayude al diagnóstico para descartar una colección pleural, una neumonía necrotizante, un absceso pulmonar o una fístula broncopleural; la resonancia magnética craneal en la meningitis, incluyendo el estudio de difusión para el diagnóstico de colecciones subdurales y de infartos o lesiones isquémicas cerebrales, y la venografía para el estudio de los senos venosos durales; y la TC de alta resolución del hueso temporal, con protocolo adaptado a pediatría con menor dosis de radiación, completada con una TC craneal con contraste intravenoso en la mastoiditis, que han sustituido a la radiografía simple y proporcionan un mayor número de diagnósticos y una mejor precisión en el conocimiento de sus formas clínico-evolutivas y sus complicaciones, de importancia para decidir un posible tratamiento quirúrgico.
En el diagnóstico bacteriológico, la reacción en cadena de la polimerasa (PCR), y otras técnicas de PCR capaces de determinar el serotipo cuando no se ha aislado la cepa, permiten el diagnóstico etiológico, especialmente de muchos empiemas, en los que el cultivo del líquido pleural es negativo por el tratamiento antibiótico previo.
Respecto a la antibioticoterapia, la penicilina vuelve a ser el fármaco de elección para las neumonías neumocócicas. El importante descenso de los porcentajes de resistencia a la penicilina y las cefalosporinas se debe, por una parte, a la desaparición de los serotipos vacunales más resistentes por la vacunación, y por otra, a la disminución de los puntos de corte de las concentraciones mínimas inhibitorias, motivada por la realidad clínica, según se trate de infecciones del sistema nervioso central o de otras localizaciones.
En la epidemiología de la enfermedad neumocócica invasiva (ENI) han ocurrido cambios importantes. La incidencia de la causada por serotipos vacunales en los niños menores de 5 años, determinada antes y después de la introducción de la vacunación sistemática con la VCN7v, ha disminuido de manera significativa (98%), pero se ha observado un aumento de la originada por serotipos no vacunales (29%), principalmente por el 19A, con un descenso de la tasa total de enfermedad invasiva (77%), según datos de los Estados Unidos. La vacunación neumocócica sistemática durante el periodo 2000-2008 presenta, pues, un balance positivo: grandes beneficios y algunas limitaciones.
No obstante, este reemplazo «posvacunal» de serotipos tiene una génesis multifactorial y hay que seguir investigando. Como con otras bacterias, debe tenerse en cuenta la evolución o las fluctuaciones naturales o espontáneas de los serotipos en el tiempo (tendencias temporales observadas ya en el pasado), por áreas geográficas y con independencia de la aplicación de la vacuna en una zona determinada.
Además, pueden interactuar distintos factores, como la introducción de antiinfecciosos y la aparición posterior de resistencias a ellos; la mejora de las condiciones socioeconómicas; el incremento del número de personas pertenecientes a grupos de riesgo, con inmunodeficiencias y enfermedades crónicas; los cambios en el programa de vigilancia epidemiológica; las modificaciones en la práctica clínica (hemocultivos para detectar bacteriemia y neumonía, e introducción de la PCR en muestras con cultivo negativo); el aumento de la población inmigrante; la presión antibiótica selectiva (por ejemplo, con los macrólidos), y la introducción de la VNC7v. Ahora, la epidemiología ha vuelto a modificarse tras la introducción de la VNC13v.
Vacuna antineumocócica conjugada 13-valente en el niño
La VNC13v fue aprobada en 2010 para sustituir a la VNC7v en niños con edades comprendidas entre las 6 semanas y los 5 años, tanto en los Estados Unidos como en la Unión Europea. La mayoría de los estudios de efectividad de la VCN13v frente a la ENI han demostrado que su introducción ha reducido su incidencia en población vacunada y no vacunada, en comparación con la anterior VCN7v, independientemente del país y del esquema de vacunación utilizado (2-7).
a) Enfermedad neumocócica invasiva
En una reciente publicación (2) se revisa el efecto de la introducción de la VNC13v en los primeros 3 años de implementación en los Estados Unidos con el esquema de 2, 4, 6 y 12-15 meses. En un estudio de vigilancia epidemiológica activa poblacional en 10 territorios preestablecidos de los Estados Unidos se ha evaluado el impacto sobre la incidencia de la ENI por los serotipos no presentes en la VNC7v, y se ha observado una continua reducción de los casos producidos, del 93%, 75%, 72%, 62% y 58% en la población de <5 años, 5-17 años, 18-49 años, 50-64 años y ≥65 años, respectivamente.
El análisis de la incidencia de los serotipos no vacunales demuestra una posible y precoz evidencia de reemplazo en los adultos, en los grupos de 18-49 años y 50-64 años, del 13% y el 26%, respectivamente. Moore et al. (2), en su estudio, no han podido demostrar una reducción en los casos de ENI causados por el serotipo 3, y concluyen que hacen falta más estudios que demuestren la efectividad frente a este serotipo y sobre el estado de portador nasofaríngeo . Se estima que la introducción de la VCN13v, durante estos primeros 3 años, ha evitado 30.000 casos de ENI y 3000 muertes.
En Canadá (4), con la VCN13v en el periodo 2010-2012, se redujo la incidencia de ENI en menores de 5 años de 18,0 a 14,2 casos por 100.000 habitantes; en la producida por los serotipos vacunales la reducción fue del 66% al 41% (p <0,001) en los menores de 5 años y del 54% al 43% (p <0,001) en los mayores de 5 años. La ENI por el serotipo 19A se redujo del 19% al 14% (p <0,001), y la producida por el 7F pasó del 14% al 12% (p = 0,04); por el contrario, los serotipos 22F y 3 aumentaron del 7% al 11% (p <0,001) y del 7% al 10% (p = 0,22), respectivamente.
La VNC13v se introdujo en Inglaterra, Gales e Irlanda del Norte con la pauta 2 + 1 a los 2, 4 y 12 meses de edad. Según los datos del Departamento de Salud Pública de Inglaterra y Reino Unido (5), en el periodo de abril de 2010 a octubre de 2013 se comunicaron 706 casos de ENI. La efectividad de la vacuna después de dos dosis en los menores de 12 meses y de una dosis en los mayores de esta edad fue del 75% (intervalo de confianza del 95% [IC95%]: 58-84).
La efectividad para los serotipos vacunales comunes (presentes en la VNC7v) fue del 90% (IC95%: 34-98) y del 73% (IC95%: 55-84) para cuatro de los seis serotipos adicionales, ya que no fue posible demostrar la efectividad para el serotipo 3 y no hubo casos del serotipo 5 durante el periodo de estudio. En una publicación posterior (8) se ha observado, durante el año 2014, un aumento de la ENI por serotipos no vacunales en los menores de 5 años y en los adultos de 45 o más años de edad.
En un estudio de cohortes de base poblacional realizado en Dinamarca (6) se compararon distintos periodos: 2000-2007 (periodo prevacunal), 2008-2010 (periodo VNC7v) y 2011-2013 (periodo VNC13v). La efectividad después de la VNC13v para la población general fue del 21% (IC95%: 17-25), y en los niños menores de 24 meses fue del 71% (IC95%: 62-79). La mortalidad por ENI se redujo un 28% (IC95%: 18-37), en todos los grupos de edad y también en población no vacunada. Tras la introducción de la VNC7v se observó un aumento en el número de casos producidos por el serotipo 19A, que descendió de manera drástica con la introducción de la VNC13v.
En un estudio realizado en Israel (7) también se halló una gran efectividad. Se trata de un estudio prospectivo sobre ENI en el periodo 2004-2013. La reducción de la incidencia de ENI por los serotipos comunes y el 6A fue del 95% (incidence rate ratio [IRR]: 0,05; IC95%: 0,03-0,09). Esta reducción fue del 90% en el periodo de utilización de la VNC7v y un 5% adicional con la introducción de la VNC13v. La incidencia de ENI por los cinco serotipos adicionales (todos menos el 6A) aumentó inicialmente un 47%, con una reducción posterior del 79%; la disminución global, para todo el periodo de observación fue del 70% (IRR: 0,30; IC95%: 0,21-0,44). Se observó un cierto grado de reemplazo de serotipos, especialmente del 12F, el 15 B/C y el 33F (IRR: 2,43; IC95%: 1,73-3,66).
b) Neumonía adquirida en la comunidad
Con la introducción de la VNC7v se observó, en diversos países, una marcada reducción de la neumonía adquirida en la comunidad (NAC), especialmente en los niños vacunados menores de 2 años. Sin embargo, también hubo un aumento, en todo el mundo, de la incidencia de casos graves de NAC con derrame pleural y empiema causados por los serotipos 1, 3, 5, 7F y 19A, todos ellos incluidos en la VNC13v.
En Uruguay (9), la VNC7v fue introducida en 2008 y la VNC13v en 2010 con la pauta vacunal de 2 + 1, lo que supuso una reducción de la incidencia de NAC en los niños de 0 a 14 años de edad en comparación con el periodo prevacunal. Las tasas de hospitalización se redujeron un 78,1% tras la introducción de la VNC7v, y esta reducción llego al 92,4% con la VNC13v; en este segundo periodo, fueron los serotipos adicionales, especialmente el 1 y el 5, los más afectados.
En Francia (10), el cambio de la VNC7v por la VNC13v se realizó en junio de 2010. Se llevó a cabo un estudio observacional prospectivo en ocho servicios de urgencias entre junio de 2009 y mayo de 2014 para establecer la incidencia de NAC con confirmación radiológica en niños de entre 1 mes y 15 años de edad. El total de casos analizados fue de 5645, de los cuales 365 tuvieron derrame pleural y en 136 se confirmó la etiología neumocócica.
El dato más relevante, comparando los periodos prevacunal y posvacunal, fue la reducción de un 16% de cualquier tipo de NAC y de un 63% de la NAC neumocócica (p <0,001). La disminución del número de derrames pleurales fue del 53% (p <0,001), y la presencia de los serotipos vacunales adicionales se redujo un 74%. La disminución de la NAC se observó tanto en pacientes vacunados como en no vacunados (inmunidad de grupo).
c) Otitis media aguda
La introducción de la VNC7v redujo significativamente las visitas médicas por otitis media aguda (OMA), entre un 6% y un 7,8%, y la prescripción antibiótica en un 5,7% (11). En un estudio (12) se comprobó un mayor impacto en la OMA recurrente, en concreto una reducción en la colocación de tubos de timpanostomía entre el 20% y el 24%, con una eficacia vacunal frente a la OMA neumocócica del 34% y frente a la causada por los serotipos vacunales del 57%.
El estudio que ha demostrado un mayor impacto de la VNC13v sobre la OMA es el de Ben-Shimol et al. (13). Se trata de un estudio prospectivo de base poblacional realizado en el sur de Israel, de vigilancia epidemiológica activa, en el que se evalúa la eficacia de la introducción secuencial de la VNC7v y la VNC13v en el periodo comprendido entre julio de 2004 y junio de 2013 en niños menores de 24 meses que presentaban OMA. En 6122 casos se realizaron timpanocentesis y cultivo, que fue positivo para neumococo en 1893 niños.
La incidencia de OMA por los serotipos comunes más el 6A y por los cinco adicionales de la VNC13v disminuyó un 96% (IRR: 0,04; IC95%: 0,02-0,08) y un 85% (IRR: 0,15; IC95%: 0,07-0,30), respectivamente, en relación al periodo prevacunal (73% con la VNC7v y 23% con la VNC13v; reducción total del 96%). Se observó un aumento no significativo (IRR:1,07; IC95%: 0,72-1,58) de la OMA producida por serotipos no vacunales (15B/C, 16F, 35B). La reducción de la incidencia de OMA neumocócica fue del 77%, y la de la OMA de cualquier etiología fue del 60%.
d) Colonización nasofaríngea
La colonización nasofaríngea se considera una condición indispensable para el desarrollo de la enfermedad neumocócica y es el punto de diseminación del neumococo en la comunidad. Su reducción gracias a la vacunación con VNC7v ha llevado a una disminución de las enfermedades neumocócicas en los niños vacunados, sus familias y la comunidad (14).
Cohen et al. (15) analizaron 943 frotis faríngeos de niños de 6 a 24 meses de edad con OMA entre octubre de 2010 y marzo de 2011. De ellos, 651 habían recibido al menos una dosis de VNC13v y 285 fueron vacunados con VNC7v. Se observó una reducción significativa de la colonización nasofaríngea por cualquier neumococo en los vacunados con VNC13v respecto a los vacunados con VNC7v, con una colonización del 53,9% frente al 64,6% (p = 0,002); para los serotipos adicionales fue del 9,6% y el 20,7% (p <0,001), y para el 19A fue del 7,5% y el 15,4% (p <0,001), respectivamente.
Otro estudio muy interesante es el de Loughlin et al. (16), en el que se realizaron 1050 frotis faríngeos en niños menores de 5 años en un centro pediátrico de Boston, entre julio de 2010 y junio de 2012. Se observó una reducción del 74% de los serotipos vacunales en la colonización nasofaríngea de los niños que habían recibido la VNC13v, y del 50% en la población no vacunada. Esta reducción de la colonización nasofaríngea en la población no vacunada se igualaba en la vacunada si la cobertura vacunal superaba el 75%. En este estudio no hubo reemplazo de serotipos.
Epílogo: la vacunación antineumocócica es beneficiosa y necesaria
La medida más eficaz para la prevención de la enfermedad neumocócica, a pesar del fenómeno del reemplazo, continúa siendo la vacunación, que es una verdadera inversión en la salud. La Organización Mundial de la Salud, en el año 2007, ya consideró una prioridad introducir la VNC7v en los programas de inmunización, con especial énfasis en los países en desarrollo. La vacunación universal en la infancia es la única estrategia que permite obtener también el efecto indirecto que extiende el beneficio a los niños no vacunados y a los adultos, que ahora también pueden beneficiarse por efecto directo mediante la inmunización con la VNC13v en todas las edades de la vida.
Es imprescindible implantar y desarrollar programas de vigilancia activa, epidemiológica y microbiológica, para valorar el efecto de la vacunación sobre la incidencia de la ENI, tanto en vacunados como en no vacunados, y según grupos de edad y de riesgo. El fenómeno del reemplazo de serotipos que comienza a observarse con la VNC13v (2,7,8,13), como ocurrió con la VNC7v, aunque por el momento por serotipos menos agresivos y con una mayor incidencia en las franjas de edad adulta, y la menor efectividad frente al serotipo 3, son dos hechos que no pueden infravalorar el impacto sobre enfermedades frecuentes, y a veces graves, que está obteniendo la VNC13v. Continuaremos, como decíamos en 2003 (17) a propósito de la VNC7v con muchas luces y algunas sombras. No olvidemos que la del neumococo es una gran y compleja familia, con más de 93 serotipos.
Bibliografía
1. Liu L, Oza S, Hogan D, Perin J, Rudan I, Lawn JE, et al. Global, regional, and national causes of child mortality in 2000-13, with projections to inform post-2015 priorities: an updated systematic analysis. Lancet. 2015;385:430-40.
2. Moore MR, Link-Gelles R, Schaffner R, Lynfield R, Lexau C, Bennett NM, et al. Effect of use of 13-valent pneumococcal conjugate vaccine in children on invasive pneumococcal disease in children and adults in the USA: analysis of multisite, population-based surveillance. Lancet Infect Dis. 2015;15:301-9.
3. Singleton R, Wenger J, Klejka JA, Bulkow LR, Thompson A, Sarkozy D, et al. The 13-valent pneumococcal conjugate vaccine for invasive pneumococcal disease in Alaska native children: results of a clinical trial. Pediatr Infect Dis J. 2013;32:257-63.
4. Demczuk WHB, Martin I, Griffith A, Lefebvre B, McGeer A, Lovgren M, et al. Serotype distribution of invasive Streptococcus pneumoniae in Canada after the introduction of the 13-valent pneumococcal conjugate vaccine, 2010-2012. Can J Microbiol. 2013;59:778-88.
5. Andrews NJ, Waight PA, Burbidge P, Pearce E, Roalfe L, Zancolli M, et al. Serotype-specific effectiveness and correlates of protection for the 13-valent pneumococcal conjugate vaccine: a postlicensure indirect cohort study. Lancet Infect Dis. 2014;14:839-46.
6. Harboe ZB, Dalby T, Weinberger DM, Benfield T, Mølbak K, Slotved HC, et al. Impact of 13-valent pneumococcal conjugate vaccination in invasive pneumococcal disease incidence and mortality. Clin Infect Dis. 2014;59:1066-73.
7. Ben-Shimol S, Greenberg D, Givon-Lavi N, Schlesinger Y, Somekh E, Aviner S, et al. Early impact of sequential introduction of 7-valent and 13-valent pneumococcal conjugate vaccine on IPD in Israeli children <5 years: an active prospective nationwide surveillance. Vaccine. 2014;32:3452-9.
8. Waight PA, Andrews NJ, Ladhani SN, Sheppard CL, Slack MPE, Miller E. Effect of the 13-valent pneumococcal conjugate vaccine on invasive pneumococcal disease in England and Wales 4 years after its introduction: an observational cohort study. Lancet Infect Dis. 2015;15:535-43.
9. Pírez MC, Algorta G, Chamorro F, Romero C, Varela A, Cedres A, et al. Changes in hospitalizations for pneumonia after universal vaccination with pneumococcal conjugate vaccines 7/13 valent and Haemophilus influenzae type b conjugate vaccine in a pediatric referral hospital in Uruguay. Pediatr Infect Dis J. 2014;33:753-
10. Angoulvant F, Levy C, Grimprel E, Varon E, Lorrot M, Biscardi S, et al. Early impact of 13-valent pneumococcal conjugate vaccine on community-acquired pneumonia in children. Clin Infect Dis. 2014;58:918-24.
11. Fireman B, Black SB, Shinefield HR, Lee J, Lewis E, Ray P. Impact of the pneumococcal conjugate vaccine on otitis media. Pediatr Infect Dis J. 2003;22:10-6.
12. Eskola J, Kilpi T, Palmu A, Jokinen J, Haapakoski J, Herva E, et al. Efficacy of a pneumococcal conjugate vaccine against acute otitis media. N Engl J Med. 2001;344:403-9.
13. Ben-Shimol S, Givon-Lavi N, Leibovitz E, Raiz S, Greenberg D, Dagan R. Near-elimination of otitis media caused by the PCV13 serotypes in Southern Israel shortly after sequential introduction of PCV7/PCV13. Clin Infect Dis. 2014;59:1724-32.
14. Simell B, Auranen K, Kayhty H, Goldblatt G, Dagan R, O’Brien KL. The fundamental link between pneumococcal carriage and disease. Expert Review of Vaccines. 2012;11:841-55.
15. Cohen R, Levy C, Bingen E, Koskas M, Nave I, Varon E. Impact of 13-valent pneumococcal conjugate vaccine on pneumococcal nasopharyngeal carriage in children with acute otitis media. Pediatr Infect Dis J. 2012;31:297-301.
16. Loughlin AM, Hsu K, Silverio AL, Marchant CD, Pelton SI. Direct and indirect effects of PCV13 on nasopharyngeal carriage of PCV13 unique pneumococcal serotypes in Massachusetts’ children. Pediatr Infect Dis J. 2014;33:504-10.
17. Moraga-Llop FA, Campins-Martí M. Vacuna antineumocócica conjugada heptavalente en el niño: luces y alguna sombra. Vacunas. 2003;4:63-6.




