1. Introducción
2. La microbiota vaginal en condiciones fisiológicas
3. Probióticos y salud vaginal
4. Conclusiones
5. Bibliografía
1. Introducción

Dr. David A. Beltrán
La superficie vaginal presenta un epitelio plano multiestratificado carente de glándulas, cuyo grosor varía en función de la secreción estrogénica de la mujer, de manera que tiene unas 40 capas de células durante la edad fértil siendo mucho más fino fuera de ese periodo (más adelante y en el glosario que se ofrece en esta misma página web se da información detallada al respecto).
El epitelio vaginal se origina por división de las células del estrato basal, de manera que existe un reemplazamiento continuo de la capa superficial por las subyacentes (de aquí el nombre que se le da a veces de epitelio escamoso). A pesar de no poseer glándulas, la mucosa vaginal está recubierta por una secreción que es producto de la exudación del propio epitelio y de la procedente del cuello del útero, que le da consistencia mucosa.
Este líquido es muy rico en nutrientes, como la glucosa y diversos aminoácidos, que facilitan la colonización de la cavidad por las bacterias que constituyen la microbiota autóctona. Para evitar el establecimiento de microorganismos indeseables, presenta también concentraciones elevadas de fagocitos, linfocitos y factores solubles como defensinas, lactoferrina, proteínas del sistema complemento e inmunoglobulinas de tipo A. La abundancia del exudado también depende de la secreción estrógenica y, por lo tanto, es mayor durante la edad fértil, siendo asimismo estimulada su secreción por la presencia de organismos indeseables que son así arrastrados hacia el exterior (1).
2. La microbiota vaginal en condiciones fisiológicas
La microbiota vaginal es el conjunto de microorganismos que viven de manera natural y sin causar daño en la región vaginal. En las mujeres representa la concentración de bacterias más alta del cuerpo humano, con la excepción del colon. Los primeros datos sobre la microbiota vaginal datan de finales del siglo XIX cuando el científico alemán Albert Döderlein describió la presencia en el exudado vaginal de bacilos Gram-positivos, largos y finos, que podrían inhibir el crecimiento de patógenos debido a la producción de ácido láctico (2) (Figura 1). Algunos años más tarde, los "bacilos de Döderlein" fueron identificados mediante los métodos taxonómicos existentes en la época como Lactobacillus acidophilus (3).
Hasta 1980, se pensaba que la microbiota vaginal estaba dominada por dicha especie. Sin embargo, en los años 90 la aplicación de técnicas taxonómicas moleculares permitió descubrir que el grupo de microorganismos conocidos hasta entonces como L. acidophilus era muy diverso y, de hecho, comprendía un elevado número de especies distintas, incluyendo L. acidophilus, Lactobacillus amylolyticus, Lactobacillus amylovorus, Lactobacillus crispatus, Lactobacillus gallinarium, Lactobacillus gasseri, Lactobacillus iners, Lactobacillus jensenii y Lactobacillus johnsonii (4,5).
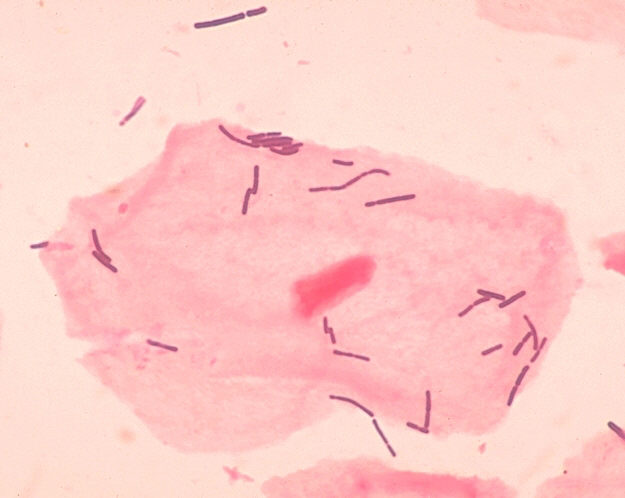
Figura 1. Célula epitelial y lactobacilos en una muestra de exudado vaginal.
La composición de la microbiota vaginal cambia notablemente con la edad, dependiendo de las variaciones en los niveles de estrógeno que se producen durante la vida de las mujeres (6,7).
Poco después del nacimiento, el epitelio vaginal es colonizado por un gran número de microorganismos. La mayoría de las bacterias vaginales se originan a partir de la microbiota del tracto gastrointestinal o de la piel circundante. Durante esta primera etapa de la infancia, los estrógenos maternos inducen un engrosamiento del epitelio vaginal y regula la deposición de glucógeno en las células epiteliales.
Durante la exfoliación de las células epiteliales, se libera glucógeno, un hecho que favorece el crecimiento de los microorganismos que fermentan la glucosa, incluyendo los lactobacilos (8). Algunos días después del nacimiento, los estrógenos maternos se metabolizan, originando un adelgazamiento de la mucosa y una disminución notable de la concentración de glucógeno.
En consecuencia, disminuyen los microorganismos que fermentan la glucosa y aumenta el pH vaginal, lo que propicia la proliferación de una amplia gama de microorganismos aerobios y anaerobios facultativos (Figura 2), incluyendo diversas especies de los géneros Veillonella, Bacteroides, Fusobacterium, Actinomyces, Peptococcus, Peptostreptococcus, Propionibacterium, Staphylococcus, Streptococcus, Enterococcus y Corynebacterium (9,10). La baja frecuencia de lactobacilos, G. vaginalis, Prevotella bivia, Mycoplasma hominis y levaduras es otra característica típica de la microbiota vaginal de las niñas prepúberes (10,11).
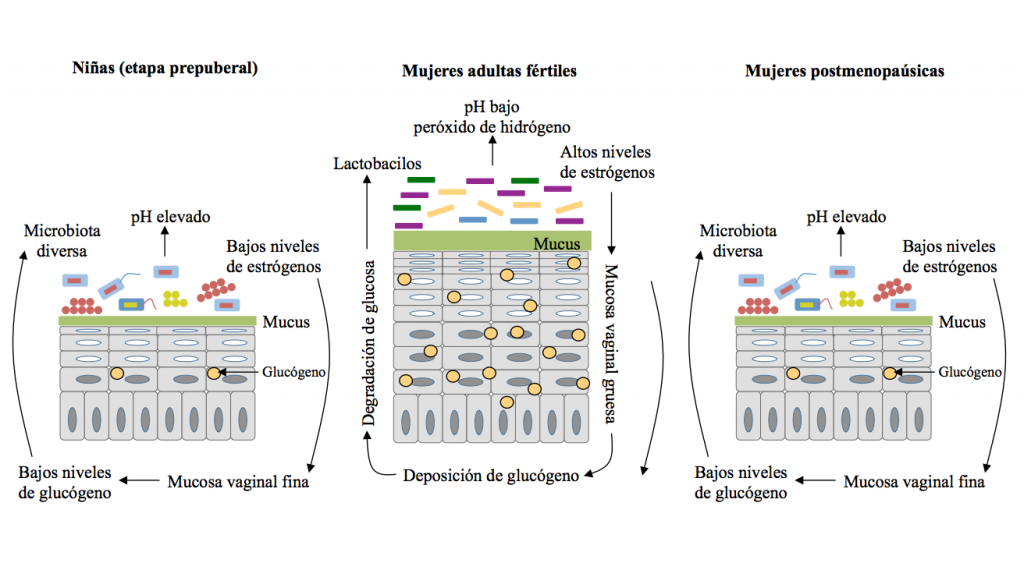
Figura 2. Cambios en la mucosa vaginal durante las distintas etapas de la vida de una mujer. Durante la prepubertad , los bajos niveles de estrógenos resultan en una mucosa delgada, con bajos niveles de glucógeno y una microbiota diversa. En la etapa adulta de la vida, los niveles de estrógenos y de glucógeno aumentan y proliferan los lactobacilos. En la postmenopausia, los niveles de estrógenos descienden otra vez, disminuye la concentración de lactobacilos y aumenta la diversidad bacteriana.
Con el comienzo de la pubertad, el epitelio vaginal vuelve a estar bajo control estrogénico, por lo que de nuevo aumenta su espesor y pasa a ser un ambiente rico en glucógeno y en microorganismos que fermentan la glucosa(12). En consecuencia, la vagina se coloniza en este período de la vida predominantemente por especies del género Lactobacillus.
La microbiota vaginal de las adolescentes es similar a la de las mujeres adultas y está dominado por L. iners, L. crispatus, L. jensenii y L. gasseri, aunque también son frecuentes Lactobacillus salivarius y Lactobacillus vaginalis (13). En un estudio que tuvo gran trascendencia se observó que la microbiota vaginal se podía dividir en cinco grandes comunidades microbianas (vaginotipos) a partir de muestras de cuatro grupos étnicos (caucásico, negro, hispano, asiático) (14) (Figura 3).
Las comunidades microbianas pertenecientes al grupo I, II, III y V estaban dominadas por L. crispatus, L. gasseri, L. iners y L. jensenii, respectivamente, mientras que el grupo IV se caracterizó por las bacterias estrictamente anaerobias, incluyendo Prevotella, Dialister, Atopobium, Gardnerella, Megasphaera y Peptoniphilus (14). Otros estudios han señalado que los ecosistemas vaginales de algunas mujeres adultas pueden ser saludables sin que su microbiota esté dominada por lactobacilos siempre que existan otras bacterias capaces de producir ácido láctico (15,17). En cualquier caso, el número exacto de vaginotipos es todavía objeto de discusión (18).
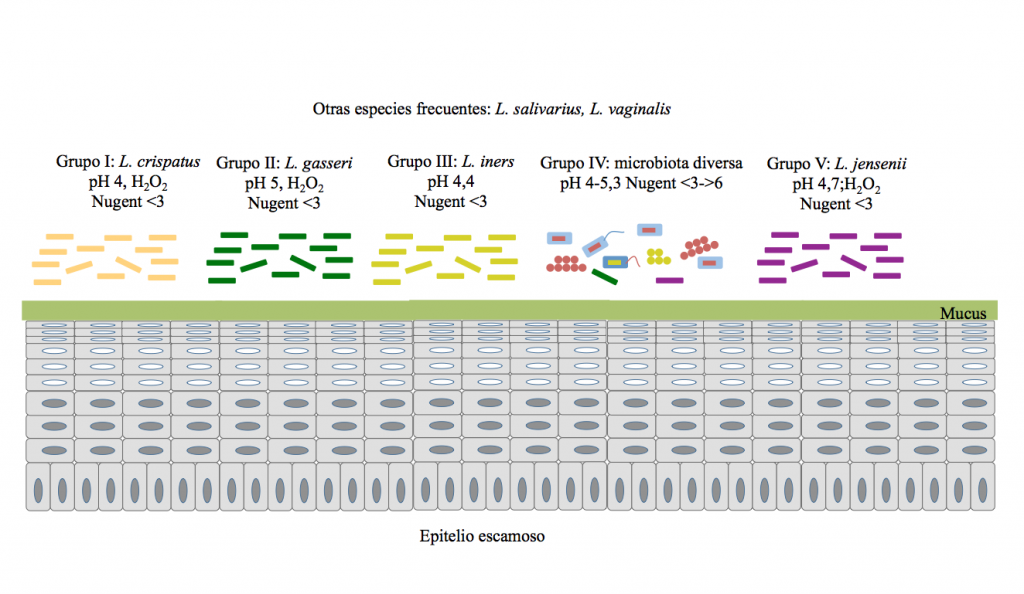
Figura 3. Composición de la microbiota vaginal en mujeres adultas sanas. La microbiota vaginal en mujeres adultas sanas se puede dividir en cinco grupos. Los grupos I, II, III y V están dominados por las especies L. crispatus, L. gasseri, L. iners y L. jensenii, respectivamente, mientras que el grupo IV es diverso en su composición. Basado en: Ravel et al. (2011).
En las mujeres postmenopáusicas, la interrupción del ciclo estrogénico se acompaña de una gran disminución del volumen de exudado vaginal y de los nutrientes disponibles. Como consecuencia, la concentración de lactobacilos se reduce drásticamente (en ocasiones hasta un 1% de los valores del periodo fértil) y aumenta el crecimiento de bacterias potencialmente patógenas (19,20). Sin embargo, casi el 50% de las mujeres conserva una población apreciable de lactobacilos y ese porcentaje puede incrementarse con terapia hormonal.
La cavidad vaginal está sometida a cambios frecuentes que alteran el equilibrio al que hemos aludido. Entre ellos está la menstruación y las relaciones sexuales. Tanto la descarga menstrual como el semen tienen pH neutro o ligeramente alcalino, lo que tiene dos consecuencias: a) los lactobacilos no crecen a esos valores de pH, por lo que su densidad disminuye, un hecho que viene agravado por el arrastre que lleva a cabo el fluido menstrual y los tampones y b) las nuevas condiciones favorecen la proliferación de G. vaginalis, C. albicans y los microorganismos entéricos y, como consecuencia, la aparición esporádica de vaginosis y vaginitis.
La disminución de la concentración de lactobacilos residentes puede ser causada también por los antibióticos que se utilizan para el tratamiento de las infecciones y que pueden pasar de la sangre a la cavidad vaginal disueltos en el exudado correspondiente.
Finalmente, los espermicidas y dispositivos intrauterinos también suelen ser tóxicos. A pesar de todo ello, existe una clara adaptación entre los lactobacilos y las condiciones imperantes en cavidad vaginal, que hace que estos cambios sean, en general, asumibles y que se vuelva rápidamente a las condiciones de homeostasis responsables de la salud genital.
Como se ha comentado anteriormente, hasta hace pocos años, la identificación bacteriana se basaba en una serie de propiedades fisiológicas (por ejemplo la capacidad de utilizar diversos azúcares) y los datos se confrontaban con tablas que permitían adscribir las características peculiares de cada bacteria a especies concretas. En esas condiciones, las especies más abundantes de lactobacilos vaginales eran L. acidophilus y Lactobacillus fermentum.
Ahora bien, el advenimiento de la clasificación por métodos moleculares reveló que los lactobacilos predominantes en vagina son L. crispatus, L. iners, L. jensenii y L. gasseri, aunque también son frecuentes Lactobacillus salivarius y Lactobacillus vaginalis (Figura 3). Por último, aparecen con alguna frecuencia lactobacilos ambientales y colonizadores del tubo digestivo como Lactobacillus rhamnosus, Lactobacillus casei o Lactobacillus plantarum.
El mutualismo Lactobacillus–mucosa vaginal se expresa por tres mecanismos principales: la interferencia con la colonización de las mucosas, la producción de compuestos antimicrobianos y la coagregación con los patógenos potenciales (1). La colonización depende del reconocimiento específico entre moléculas superficiales del microorganismo (adhesinas) y del hospedador (receptores), así como de la adaptación a las condiciones del ambiente, incluyendo la utilización eficaz de los nutrientes disponibles.
La microbiota de ocupación lleva conviviendo y evolucionando con nosotros desde siempre, por lo que sus componentes presentan un altísimo grado de adaptación a las condiciones de las cavidades orgánicas, mostrando así una ventaja capital en la competencia con otros microorganismos. Esto explica que la colonización por patógenos solo ocurra cuando se ha diezmado la microbiota autóctona (por ejemplo, tras un tratamiento con antibióticos).
Los compuestos antimicrobianos sintetizados por los lactobacilos vaginales son fundamentalmente tres: los ácidos orgánicos, el agua oxigenada y las bacteriocinas. La producción de ácido es el principal mecanismo de protección de la mucosa vaginal, hace que el pH de la misma sea de 4–4,5 dando lugar a unas condiciones que resultan ser tóxicas para la mayoría de los patógenos (el pH del resto de las mucosas y también el del interior del organismo suele estar próximo a la neutralidad).
El agua oxigenada es un antiséptico que se utiliza en la desinfección de heridas porque oxida la maquinaria celular de los microorganismos anaerobios y la inactiva. A pesar de su efecto tóxico, su producción es típica de los lactobacilos vaginales, que aguantan concentraciones relativamente elevadas de la misma, existiendo una relación directa entre la colonización por estirpes que la generan y la salud vaginal. Finalmente, las bacteriocinas son péptidos que matan a las bacterias porque abren poros en sus membranas que hacen que las células se vacíen y porque inhiben la formación de la pared que las envuelve.
Por lo que respecta a la coagregación con los patógenos, esta cualidad es muy evidente en algunos lactobacilos vaginales respecto a diversos patógenos que comparten su hábitat, como C. albicans. La trascendencia de este hecho es doble: por un lado, bloquean a las adhesinas del patógeno, que no pueden ya promover su unión a la mucosa y por otro, la vecindad de ambos microorganismos aumenta la efectividad de los compuestos antimicrobianos producidos por dicho lactobacilo.
3. Probióticos y salud vaginal
Los efectos beneficiosos que acabamos de describir condujeron al planteamiento de utilizar microorganismos obtenidos a partir de las mucosas para prevenir e incluso tratar, efectos patológicos asociados a su desaparición en las cavidades orgánicas, principalmente el intestino y la vagina. A estos organismos se les denomina probióticos. Según las normas de la Organización Mundial de la Salud sobre evaluación de los microorganismos destinados a ser usados como tales, un probiótico sería un microorganismo vivo que, cuando se administra en cantidades adecuadas, confiere un beneficio a la salud del consumidor. Queda claro pues que hablamos de un organismo externo al individuo que, en general, requiere de cantidades muy elevadas, del orden de 100 a 1000 millones de células por dosis, para ejercer un efecto notable.
Se considera que los probióticos tienen efecto adyuvante en el tratamiento de la vaginosis bacteriana y de la vaginitis infecciosa. Esto significa que se han de utilizar tras el tratamiento de la infección con antibióticos, con el objetivo de que se produzca una recolonización de la mucosa y un descenso del pH vaginal antes de que el patógeno se pueda recuperar. Por eso mismo, se consideran útiles en la prevención de las recurrencias (recidivas y reinfecciones) de las infecciones vaginales y urinarias, incluyendo la vulvovaginitis candidiásica recurrente.
La evidencia científica del efecto saludable de los probióticos después de la menopausia es limitada, pero aún así hay datos que permiten recomendarlos como adyuvantes en las pacientes con clínica vaginal. Es posible que el tratamiento de la paciente con estrógenos mejore los resultados, ya que se induciría una rehidratación de la mucosa vaginal que facilitaría la colonización por los lactobacilos, la disminución del pH vaginal y el efecto antimicrobiano consiguiente.
Las vías de administración de los probióticos vaginales son dos, la oral y la vaginal. En el primer caso, suelen usarse cápsulas y en el segundo óvulos, aunque recientemente se han comercializado tampones en cuyo interior se encuentran los lactobacilos. Independientemente del tipo de presentación, las bacterias se suministran como cultivos refrigerados o liofilizados.
Los primeros aseguran un inicio de actividad casi inmediato pero su viabilidad depende de un mantenimiento adecuado de la cadena de frío hasta su utilización por la paciente; los liofilizados requieren de unas horas para rehidratarse e iniciar la colonización, a cambio, no son tan dependientes de unas condiciones de conservación adecuadas (pueden permanecer a temperatura ambiente durante periodos limitados de tiempo, sin pérdida de viabilidad). Habitualmente, por vía vaginal se instilan 10 (8) bacterias viables/día durante 5‐10 días. La vía oral requiere dosis de 10 (9) bacterias/día durante 15–30 días. Como ya se indicó, en el caso de una infección activa, la administración se iniciaría tras el tratamiento antibiótico.
Aunque no hay evidencia suficiente para recomendar una posología determinada en la prevención de recurrencias, el sentido común dicta que debería instaurarse el tratamiento al final de la menstruación, que es cuando la mucosa puede estar más despoblada de lactobacilos y el pH vaginal transitoriamente elevado. Se provocaría así una generación acelerada de ácido, que inhibiría la proliferación excesiva de los patógenos potenciales y crearía las condiciones adecuadas para la repoblación, tanto por los lactobacilos instilados como por los autóctonos.
En conclusión, los probióticos en Ginecología representan una alternativa prometedora, en espera de nuevos estudios que nos permitan perfeccionar los distintos aspectos de los protocolos de utilización.
4. Conclusiones
▪ La microbiota vaginal es el conjunto de microorganismos que habitan en vagina en condiciones fisiológicas y que con la excepción del colon, constituyen la concentración más alta de bacterias del cuerpo de la mujer.
▪ La composición de la microbiota vaginal varía a lo largo de la vida de la mujer, dependiendo fundamentalmente de los niveles de estrógenos y pudiéndose alterar el equilibrio existente por diversos factores entre los que destacan la menstruación y las relaciones sexuales.
▪ La síntesis de antimicrobianos por los lactobacilos resulta de manera indudable crucial para el mantenimiento de la homeostasis de la microbiota vaginal.
▪ A la luz de los resultados de los ensayos clínicos realizados hasta el momento actual, los probióticos representan una alternativa prometedora en el abordaje preventivo y terapéutico de las infecciones vulvovaginales.
5. Bibliografía
1. Suárez, Beltrán DA, Daza M, González SP, Guerra JA, Jurado AR, Ojeda D, Rodríguez JM. (2015). La microbiota vaginal: composición y efectos beneficiosos. Consenso sobre usos de los probióticos en Ginecología. Sociedad Española de Probióticos y Prebióticos; http://www.sepyp.es/probiot_vaginales.pdf
2. Döderlein A (1892) Das Scheidensekret und seine Bedeutung für das Puerperalfieber. Zentbl Bakteriol Microbiol Hyg Abt 11: 699.
3. Thomas S (1928) Döderlein's Bacillus: Lactobacillus acidophilus. J Infect Dis 43:218–227.
4. Du Plessis EM & Dicks LM (1995) Evaluation of random amplified polymorphic DNA (RAPD)-PCR as a method to differentiate Lactobacillus acidophilus, Lactobacillus crispatus, Lactobacillus amylovorus, Lactobacillus gallinarum, Lactobacillus gasseri, and Lactobacillus johnsonii. Curr Microbiol 31: 114–118.
5. Falsen E, Pascual C, Sjoden B, Ohlen M, Collins MD (1999) Phenotypic and phylogenetic characterization of a novel Lactobacillus species from human sources: description of Lactobacillus iners sp. nov. Int J Syst Bacteriol 49(Pt 1):217–221.
6. Cribby S, Taylor M, Reid G (2008) Vaginal microbiota and the use of probiotics. Interdiscip Perspect Infect Dis 29: 256490.
7. Petrova MI, van den Broek M, Balzarini J, Vanderleyden J, Lebeer S. Vaginal microbiota and its role in HIV transmission and infection. FEMS Microbiol Rev. 2013 Sep;37(5):762-92.
8. Boskey ER, Telsch KM, Whaley KJ, Moench TR, Cone RA (1999) Acid production by vaginal flora in Vitro is consistent with the rate and extent of vaginal acidification. Infect Immun 67: 5170–5175.
9. Dei M, Di MF, Di PG, Bruni V (2010) Vulvovaginitis in childhood. Best Pract Res Clin Obstet Gynaecol 24: 129–137.
10. Randelovic G, Mladenovic V, Ristic L, Otasevic S, Brankovic S, Mladenovic-Antic S, Bogdanovic M, Bogdanovic D (2012) Microbiological aspects of vulvovaginitis in prepubertal girls. Eur J Pediatr 171: 1203–1208.
11. Tolino A, Scognamiglio G, Liguori G, Petrone A, Borruto Caracciolo G, Nappi C. Puberal hormonal status and vaginal microbiology.Acta Eur Fertil. 1994 Nov-Dec;25(6):343-6.
12. Mac Bride MB, Rhodes DJ, Shuster LT (2010) Vulvovaginal atrophy. Mayo Clin Proc 85: 87–94.
13. Yamamoto T, Zhou X, Williams CJ, Hochwalt A, Forney LJ (2009) Bacterial populations in the vaginas of healthy adolescent women. J Pediatr Adolesc Gynecol 22: 11–18.
14. Ravel J, Gajer P, Abdo Z et al. (2011) Vaginal microbiome of reproductive-age women.P Natl Acad Sci USA 108: 4680–4687.
15. Zhou X, Bent SJ, Schneider MG, Davis CC, Islam MR, Forney LJ (2004) Characterization of vaginal microbial communities in adult healthy women using cultivation-independent methods. Microbiology 150: 2565–2573.
16. Zhou X, Brown CJ, Abdo Z, Davis CC, Hansmann MA, Joyce P, Foster JA &Forney LJ (2007) Differences in the composition of vaginal microbial communities found in healthy Caucasian and black women. ISME J 1: 121–133.
17. Srinivasan S, Hoffman NG, Morgan MT et al. (2012) Bacterial communities in women with bacterial vaginosis: high resolution phylogenetic analyses reveal relationships of microbiota to clinical criteria. PLoS ONE 7: e37818.
18. Ma B, Forney LJ, Ravel J (2012) Vaginal microbiome: rethinking health and disease. Annu Rev Microbiol 66: 371–389.
19. Gupta S, Kumar N, Singhal N, Kaur R, Manektala U (2006) Vaginal microflora in postmenopausal women on hormone replacement therapy. Indian J Pathol Microbiol 49: 457–461.
20. Hummelen R, Macklaim JM, Bisanz JE, Hammond JA, McMillan A, Vongsa R, Koenig D, Gloor GB, Reid G (2011b) Vaginal microbiome and epithelial gene array in post-menopausal women with moderate to severe dryness. PLoS ONE 6: e26602.




