Redacción Farmacosalud.com
Una novedosa terapia avanzada, basada en el uso de células madre implantadas en un modelo óseo sintético, es capaz de estimular los huesos maxilares para que sean capaces de regenerarse y, de esta manera, permitir la colocación de implantes dentales en casos muy difíciles de tratar debido a la presencia de severos defectos óseos. El modelo sintético es un sustituto de hueso cerámico con una composición de un 60% de hidroxiapatita y un 40% de beta fosfato tricálcico.
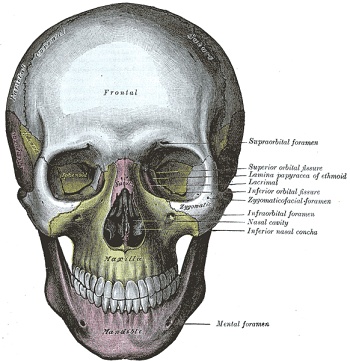
En tono amarillento, maxilar superior. En tono rosáceo, maxilar inferior o mandíbula
Autoría y fuente: Henry_Vandyke_Carter: Henry Vandyke Carter. Gray's Anatomy-Henry Gray. Anatomy of the Human Body (See "Libro" section below) Bartleby.com: Gray's Anatomy, Plate 190
Difusión: Wikipedia
Este prototipo “tiene una estructura micro y macroporosa muy similar a la arquitectura ósea humana y con un patrón de reabsorción en el que el material se va disolviendo gradualmente, liberando iones de calcio y fosfato que promueven la formación de hueso nuevo, que eventualmente reemplazará el espacio ocupado por este biomaterial”, explica el Prof. Mariano Sanz Alonso, patrono de Honor de la Sociedad Española de Periodoncia y Osteointegración (SEPA), organización de la que Sanz fue presidente.
Distintos grupos de investigación de todo el mundo están buscando alternativas biológicas que estimulen y mejoren la capacidad regenerativa de los biomateriales que se emplean actualmente para hacer frente a aquellos defectos óseos en los maxilares que impiden o dificultan la colocación de implantes y, por tanto, la rehabilitación de los dientes perdidos.
Ahora, por primera vez, se ha documentado en pacientes el beneficio derivado de la terapia basada en la utilización de células madre implantadas en un sustituto óseo sintético. El ensayo correspondiente, que ha sido financiado por la Unión Europea a través del programa EU Horizon 2020, ha contado con la participación de dos instituciones académicas españolas (Universidad Complutense de Madrid -UCM- y Universidad Internacional de Catalunya -UiC-), junto con centros de Francia, Alemania, Dinamarca y Noruega.
Células madre autólogas
El nuevo estudio es un ensayo clínico aleatorizado y controlado de fase 2 en el que se ha evaluado la seguridad y eficacia de una terapia celular con células mesenquimales autólogas* expandidas, para ser posteriormente sembradas en un sustituto óseo sintético bioabsorbible recubierto con una membrana no reabsorbible. Los investigadores querían reconstruir maxilares atróficos utilizando células madre autólogas tomadas mediante punciones en la cresta ilíaca.
*células autólogas: células del propio paciente
“Efectivamente, en este estudio obtuvimos las células madre del paciente a través de punciones en la cresta ilíaca (cadera). La cresta ilíaca es el hueso de acceso más superficial del que se obtiene mejor calidad de médula ósea, que es donde se concentra la mayor proporción de células mesenquimales. En este momento, estamos estudiando en nuestro laboratorio la posibilidad de obtener agentes mesenquimales a partir de pequeñas microbiopsias de encía, lo que resultaría mucho más sencillo y con menos morbilidad para el paciente. Sin embargo, todavía estamos en fase de estudios in vitro y en animales de experimentación, por lo que tendremos que esperar para valorar su traducibilidad a humanos”, expone a www.farmacosalud.com Sanz, a su vez catedrático de Periodoncia de la UCM.
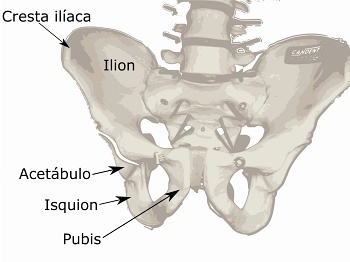
Autoría y fuente: derivative work: LP (talk) Pelvis_diagram.png: Original uploader was Je at uwo at en.wikipedia - Pelvis_diagram.png
Difusión: Wikipedia
El programa EU Horizon 2020 financia consorcios de universidades, instituciones e industria que plantean un proyecto de innovación concreto, como el que gira en torno al tratamiento celular combinado con el modelo óseo sintético. Un aspecto relevante de este abordaje terapéutico es que se apoya en un sustituto artificial, con los beneficios que ello supone: “la gran ventaja de un sustituto sintético es que no requiere una fuente de hueso natural ni animal, ni tampoco humana, lo que facilita su disponibilidad y lo hace más sostenible; además, los nuevos sustitutos sintéticos permiten su manufacturación industrial con las características físico-químicas ideales para la regeneración ósea”, declara el patrono de Honor de SEPA.
En este caso, el elemento fabricado es un andamiaje que permite mantener el espacio para que el propio hueso estimulado por el efecto biológico de las células implantadas se introduzca en la estructura porosa del sustituto, que eventualmente se reabsorbe hasta que finalmente es reemplazado por hueso nativo, vivo y funcional.
“Nuestro grupo lleva años investigando, tanto en el laboratorio como en animales, el potencial de esta terapéutica; por lo tanto, es consecuencia lógica que, cuando ha surgido la oportunidad de utilizar esta alternativa en personas, hayamos sido pioneros”, sostiene Sanz, quien forma parte del Grupo de Investigación en Etiología y Terapia de las Enfermedades Periodontales y Periimplantarias (ETEP) de la Facultad de Odontología de la Complutense.
“Buscamos estimular el hueso para que sea capaz de reconstruir su dimensión tridimensional”
Cuando los defectos óseos observados en los maxilares son pequeños o moderados, las tecnologías actuales tienen muy buena predictibilidad y los resultados son muy positivos. Sin embargo, en grandes defectos, cuando se requiere la reconstrucción tridimensional del hueso del maxilar o de la mandíbula, las técnicas actuales no aportan unos resultados muy predecibles y dependen mucho de la destreza del cirujano. De ahí la importancia de encontrar nuevas soluciones para rehabilitar los dientes perdidos en sujetos con graves deficiencias óseas, para los que actualmente hay muchas limitaciones en el ámbito de la implantología.
“Con estas terapias avanzadas, como la terapia con células madre, buscamos estimular el hueso con el fin de que sea capaz de reconstruir su dimensión tridimensional y, de ese modo, permitir la colocación de implantes dentales en su posición ideal para que, una vez que queden integrados en el hueso, puedan colocarse las prótesis adecuadas que rehabiliten la función y la estética de la dentición perdida”, apunta mediante un comunicado el experto y primer firmante del artículo ‘Bone Augmentation of Atrophic Alveolar Ridges Using a Synthetic Bone Substitute With Mesenchymal Stem Cells: A Randomized, Controlled Clinical Trial’.
Autor/a: anusorn_nakdee
Fuente: depositphotos.com
Mejores resultados que la terapia regenerativa convencional
En el artículo que recoge los pormenores del nuevo ensayo se habla de la obtención de resultados ‘favorables’. Se incluyeron y aleatorizaron un total de 48 pacientes (36 personas en el grupo de prueba y 12 en el grupo de control). Al ser un ensayo clínico, el efecto del tratamiento avanzado propuesto (células madre implantadas en un sustituto óseo sintético) se ha comparado con la terapia ósea regenerativa más empleada para este tipo de recomposiciones (grupo control), que es la utilización de un bloque de hueso tomado de la rama posterior de la mandíbula del propio paciente. Los resultados, recogidos en ‘Clinical Oral Implants Research’, demuestran una reconstrucción tridimensional del hueso significativamente mayor en el grupo de terapia celular, con ganancias en milímetros cúbicos de hueso de casi el doble en comparación con el grupo control.
No obstante, “nuestros resultados son difíciles de trasladar directamente a la clínica, ya que las terapias celulares, tanto en nuestro campo como en el resto de los campos médicos, están muy restringidas, fundamentalmente por barreras regulatorias”, matiza el Prof. Sanz. Como es lógico, las agencias nacionales de medicamentos tienen que asegurarse de que el manejo de esas células se realiza en condiciones óptimas de seguridad para los pacientes. Sin embargo, y a pesar de que los costes asociados a esta clase de técnicas son muy altos, “nuestros resultados abren una puerta importante para seguir investigando en tecnologías que optimicen la manipulación celular y, por lo tanto, faciliten su uso y reduzcan los costes actuales”, apostilla el catedrático de la UCM.
En estudio, estrategias que podrían esquivar a las barreras normativas
Llegados a este punto, ¿qué podría hacerse para disminuir costes y ‘democratizar’ la nueva técnica, en caso de que fuera aprobada por las autoridades sanitarias? “El nuevo procedimiento es muy caro y poco eficiente, ya que requiere mucho tiempo, personal e instalaciones muy especializadas para poder desarrollarlo de acuerdo con los requisitos regulatorios. Se podría abaratar si mejoran las tecnologías de aislamiento y expansión celular, lo que está avanzando mucho, y probablemente en el futuro dispongamos de procesos robotizados que, utilizando IA (Inteligencia Artificial), permitan llevar a cabo esta expansión sin necesidad de interacción humana, lo que abarataría y acortaría los procesos”.

Prof. Mariano Sanz
Fuente: Paco R.
“Igualmente -prosigue-, se podrá abaratar la metodología si, en lugar de células autólogas, empleamos células humanas de banco**… o incluso podrían no aplicarse las células directamente, sino los metabolitos activos de dichas células para que puedan ejercer su efecto biológico sin tener que introducirlas en el hueso. Estas tecnologías están, en la actualidad, en estudio y nuestro grupo de investigación está participando en algunas de las iniciativas internacionales que van en esa dirección, pero todavía no estamos en disposición de comenzar ensayos clínicos”.
Sea como fuere, de todas esas vías, quizás la más interesante sea la que apuesta por usar células sin implantar células, es decir, implantando el producto de su secreción (secretoma), que mantiene la mayoría de sus propiedades biológicas, dado que, “de este modo, evitamos la mayoría de las barreras regulatorias de las terapias celulares”, destaca el Prof. Sanz. De hecho, su grupo acaba de solicitar un nuevo gran proyecto de investigación europeo que tratará de validar esta innovadora estrategia, un procedimiento que “nos puede aportar los mismos resultados excelentes con una menor morbilidad para el paciente (no será necesario extraerle sus células madre), además de suponer un menor coste y tener que enfrentarse a menos barreras normativas”.
**banco de células alogénicas (procedentes de otro individuo)
Referencia bibliográfica
Sanz M, Gjerde C, Gjertsen BT, Ortiz-Vigón et al. Bone Augmentation of Atrophic Alveolar Ridges Using a Synthetic Bone Substitute With Mesenchymal Stem Cells: A Randomized, Controlled Clinical Trial. Clin Oral Implants Res. 2025. doi: 10.1111/clr.70025.




