Redacción Farmacosalud.com
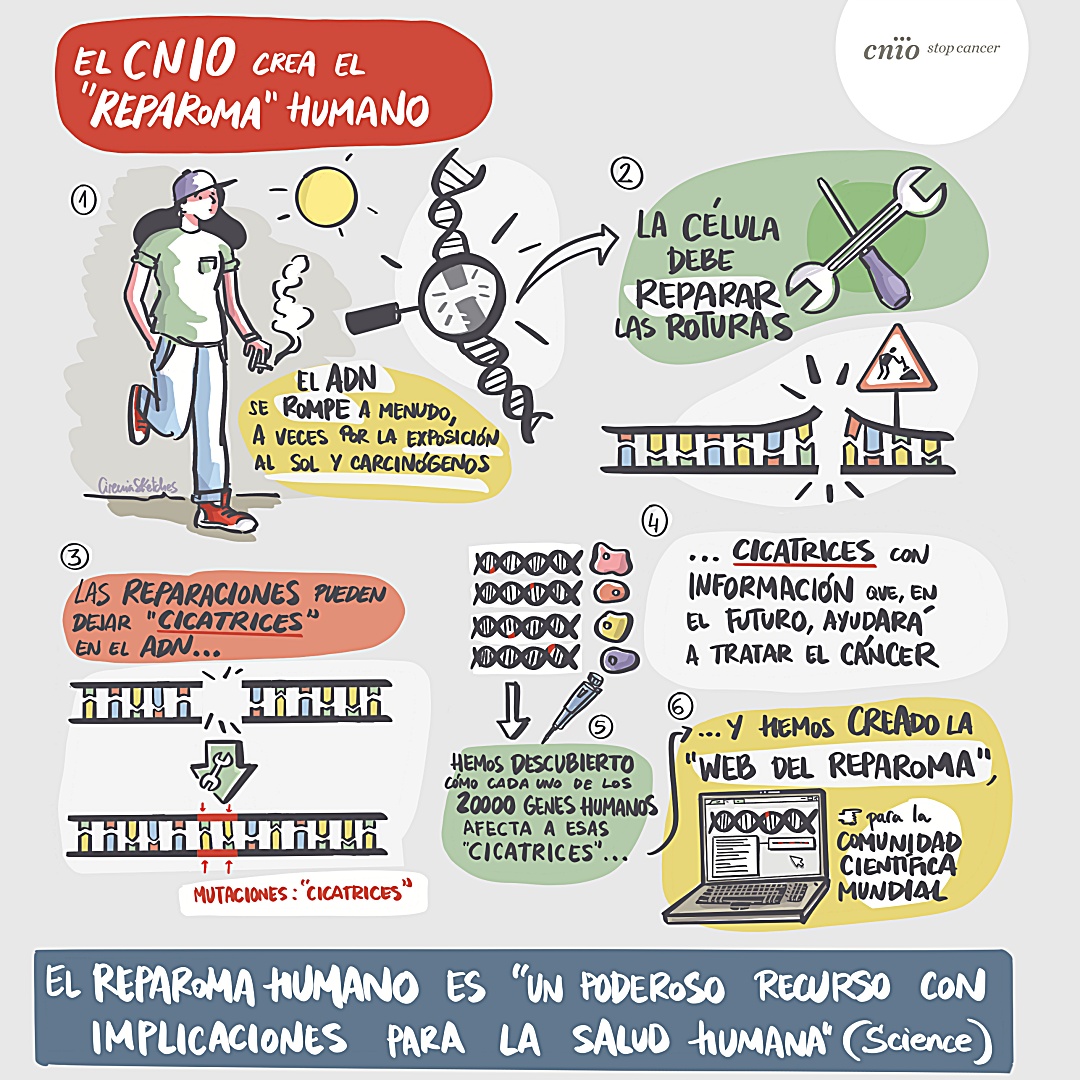
Dime cómo son tus cicatrices, y te diré quién eres. Es la idea que resume uno de los nuevos grandes avances de la investigación básica y biomédica que publica la revista ‘Science’1. El nuevo concepto, convertido en un logro del Centro Nacional de Investigaciones Oncológicas (CNIO), tiene como eje principal el ‘reparoma humano’ -en inglés REPAIRome-, entendiéndose como reparoma la reparación de roturas en la molécula de ADN (ácido desoxirribonucleico).
Un grupo del CNIO ha identificado los 20.000 tipos de cicatrices que quedan en el ADN humano reparado tras una rotura. Después las ha organizado en una web, el portal del reparoma humano, que queda a disposición de la comunidad científica mundial. Así, el reparoma humano viene a ser el catálogo de los patrones de cicatrices en el ADN humano recompuesto. Se trata de una información muy valiosa como conocimiento básico, pero también desde el punto de vista médico. Por ejemplo, poder interpretar el patrón de cicatrices en las células tumorales de un paciente puede ayudar a determinar el mejor tratamiento para cada cáncer.
Infografía sobre el reparona humano
Autoría: @CireniaSketches, CNIO
Fuente: CNIO
‘Arreglos’ que dejan huella
“Es un trabajo ambicioso, que esperamos que se convierta en un recurso verdaderamente útil en la investigación oncológica y también en la práctica clínica”, dice el Dr. Felipe Cortés, jefe del grupo de Topología y Roturas de ADN del CNIO y autor principal del trabajo. Para Ernesto López, uno de los primeros autores del estudio, “ha sido un esfuerzo arduo y concienzudo porque son unos 20.000 patrones, tantos como genes en el ADN humano”.
El ADN está en todas nuestras células y es la molécula de que están hechos los genes, las instrucciones moleculares que dirigen el funcionamiento del cuerpo. Pero el ADN sufre roturas continuamente, por el propio funcionamiento celular y a menudo por motivos tan cotidianos como la exposición al sol. Son heridas peligrosas, que la célula debe reparar para sobrevivir. Los ‘arreglos’, no obstante, dejan huella. Cada reparación deja tras de sí un rastro de alteraciones genéticas, de mutaciones. Los investigadores hablan de “huella mutacional” o, metafóricamente, de las cicatrices que quedan tras la recomposición.
Esas huellas encierran una información altamente codiciada. Igual que las marcas en la piel son distintas tras un corte y una quemadura, las alteraciones en el ADN tras una reparación delatan el tipo de daño sufrido. También revelan otros detalles sobre, por ejemplo, cómo la célula ha arreglado la rotura. En la piel, la cicatriz dice al ojo experto el punto de sutura empleado; en el ADN, la huella mutacional dice qué mecanismos de reparación ha usado la célula. Así, decodificar la cicatriz para entender el daño original, y su remiendo, es importante en muchas áreas de investigación y específicamente en cáncer. “Es algo muy relevante para el tratamiento del cáncer, porque muchas terapias oncológicas funcionan precisamente provocando roturas en el ADN”, explica Cortés.
A menudo los tratamientos oncológicos dejan de funcionar porque las células tumorales aprenden a reparar las roturas que producen los fármacos, con lo que los tumores se hacen resistentes a la terapia. Entender cómo la célula soluciona las roturas en cada caso puede ayudar a vencer las resistencias.

(de izq. a dcha): los investigadores Ernesto López, Felipe Cortés, Daniel Giménez e Israel Selguero
Autoría: Marina Bejarano, CNIO
Fuente: CNIO
El patrón cicatricial es diferente según qué genes falten o estén presentes
Hay un detalle que da sentido al reparoma humano: el patrón de cicatrices que queda en el ADN de una célula es diferente según qué genes falten o estén presentes. Este punto es clave, porque ha hecho posible el actual avance. El logro del grupo del CNIO ha consistido en desvelar cómo cada uno de nuestros genes afecta a las cicatrices. El ‘reparoma humano’ ahora publicado contiene todos los patrones de cicatrices posibles: contempla la huella mutacional provocada por roturas en el ADN en 20.000 poblaciones de células diferentes, cada una de ellas sin un gen específico. De esta forma, “si se observan unas cicatrices determinadas en el ADN de tumores se puede inferir qué genes no están funcionando, y esto es útil para diseñar tratamientos específicos”, explica Cortés.
La elaboración del reparoma humano ha exigido por tanto una labor exhaustiva. Los investigadores del CNIO generaron unas 20.000 poblaciones celulares distintas, inhabilitando (apagando) un gen diferente en cada una de ellas; después provocaron roturas en cada una de ellas, utilizando la herramienta de edición genética CRISPR. Finalmente observaron la huella (cicatriz) que quedaba en la molécula después de que la célula arreglara la herida.
Uno de los principales avances que han hecho posible el estudio ha sido realizar este análisis masivo simultáneamente en las 20.000 poblaciones, y no una a una. Es un desarrollo tecnológico específico que tiene valor por sí mismo y, “puede emplearse para futuros estudios que pretendan analizar simultáneamente el efecto de todos los genes humanos”, señala Israel Salguero, coprimer autor del estudio. Además, “esto ha requerido de un importante esfuerzo computacional, incluyendo el desarrollo de nuevas herramientas de análisis y representación”, señala Daniel Giménez, investigador del grupo de Dinámica Cromosómica del CNIO, también coprimer autor. Por esta razón participan en esta investigación también los grupos de Oncología Computacional y de Integridad Genómica y Biología Estructural del CNIO.
Una cicatriz asociada a cáncer de riñón
Como escriben los autores del nuevo trabajo, “REPAIRome es un catálogo que muestra cómo cada uno de los alrededor de 20.000 genes humanos influye en los patrones de mutaciones que son consecuencia de la reparación de roturas del ADN. REPAIRome puede aportar información sobre los mecanismos de reparación del ADN, mejorar la edición de genes y explicar los patrones de mutación observados en el cáncer”.
El portal web del REPAIRome permitirá a investigadores de todo el mundo consultar rápidamente cómo cualquier gen humano afecta a la recomposición del ADN, analizar correlaciones funcionales entre genes y explorar rutas moleculares implicadas. Sus autores consideran REPAIRome “una plataforma para nuevos descubrimientos”, añade Cortés. De hecho, los autores exponen ya en Science hallazgos que ya ha hecho posible el REPAIRome. Entre ellos hay nuevas proteínas implicadas en la reparación del ADN, tanto promoviéndola como impidiéndola. También han descubierto un patrón de mutaciones asociado al cáncer de riñón, y también a condiciones de baja oxigenación (hipoxia) en otros tumores. Es un hallazgo del que podrían derivarse nuevas aproximaciones terapéuticas en un futuro.
Se rompe la doble hélice del ADN
REPAIRome contempla específicamente la reparación de uno de los tipos de daño más grave que puede sufrir el ADN, la rotura de doble hebra –en inglés DNA double-strand breaks (DSBs)–. Consiste en la rotura simultánea de las dos cadenas de la doble hélice de la molécula ADN, y puede ocurrir por un error durante la replicación del ADN o por factores externos, como la exposición a rayos X, a luz solar (radiación UV) o a fármacos.

Autor/a de la imagen: Gorodenkoff
Fuente: depositphotos.com
De hecho, y como ya se ha dicho, la quimioterapia y radioterapia oncológicas matan a las células tumorales provocando este tipo de roturas, de ahí la importancia biomédica de entender cómo se reparan. El conocimiento del reparoma humano puede en ese sentido ayudar a identificar nuevas dianas terapéuticas. También esperan que contribuya a mejorar las actuales herramientas de edición genética, ya que los nuevos sistemas CRISPR-Cas se basan precisamente en la inducción de roturas para provocar cambios específicos en el ADN. “Comprender en profundidad cómo operan los mecanismos de reparación de las roturas de doble cadena (…) es un área de extraordinario interés, con implicaciones para la salud humana, incluyendo la biología y el tratamiento del cáncer, así como para nuestros esfuerzos hacia un control total de las tecnologías de edición genética CRISPR-Cas”, escriben en ‘Science’. El REPAIRome “es un recurso poderoso para la comunidad científica, y especialmente para aquellos interesados en la reparación DSB y el uso biotecnológico y médico de los sistemas CRISPR-Cas”, añaden.
Este proyecto ha sido financiado con fondos públicos estatales y europeos a través a través del programa conjunto ‘A way of making Europe’ del Ministerio de Ciencia, Innovación y Universidades (Agencia Española de Investigación, AEI) y de los fondos FEDER. Algunos de los investigadores e investigadoras participantes han recibido fondos principalmente estatales de la AEI y la Comunicad Autónoma de Madrid, y becas de la Fundación ‘la Caixa’ y la Asociación Española Contra el Cáncer (AECC).
La FDA aprueba lurbinectedina + atezolizumab para el cáncer de pulmón
Por otro lado, PharmaMar anuncia que la Food and Drug Administration (FDA) de EE.UU. ha aprobado Zepzelca® (lurbinectedina) en combinación con atezolizumab (Tecentriq®) como tratamiento en primera línea de mantenimiento para adultos con cáncer de pulmón de célula pequeña (CPCP) en estadio avanzado, cuya enfermedad no ha progresado tras el tratamiento de inducción de primera línea con atezolizumab, carboplatino y etopósido2. La aprobación supone la primera terapia combinada para el tratamiento en primera línea de mantenimiento para CPCP en estadio avanzado, un cáncer agresivo y de rápido crecimiento con limitadas opciones terapéuticas.
La aprobación de la Agencia del Medicamento de Estados Unidos está basada en los resultados del ensayo de Fase 3 IMforte, que demostró que la combinación de lurbinectedina con atezolizumab redujo el riesgo de progresión de la enfermedad o muerte en un 46% y el riesgo de defunción en un 27%, en comparación con atezolizumab en monoterapia en mantenimiento. Tras cuatro ciclos de terapia de inducción, desde la aleatorización, la mediana de supervivencia global (OS) para el régimen combinado fue de 13,2 meses frente a 10,6 meses ([HR]= 0,73; IC del 95%: 0,57-0,95; p = 0,0174). Desde el momento de la aleatorización, la mediana de supervivencia libre de progresión (PFS) según la evaluación independiente fue de 5,4 meses frente a 2,1 meses, (HR = 0,54, IC del 95 %: 0,43-0,67; p < 0,0001).
Kenko BreastAI+, una solución para la detección precoz del cáncer de mama
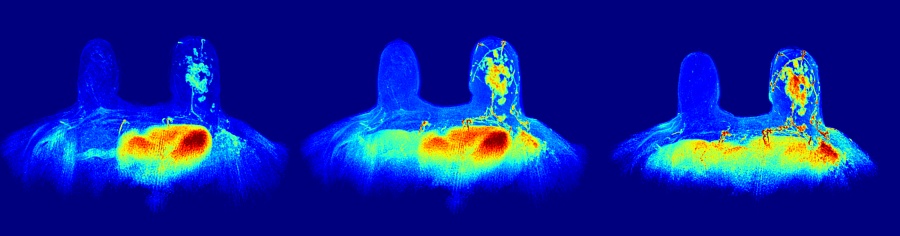
En otro orden de cosas, la empresa Kenko Imalytics -spin-off de la Universidad Politécnica de València (UPV)- lanzará en los próximos casos la solución Kenko BreastAI+, una plataforma online capaz de encontrar la localización del cáncer de mama y sus zonas de agresividad, además de aportar información útil para la identificación del subtipo tumoral con una sensibilidad del 99%. Esta solución permite analizar secuencias de resonancia magnética y, con ellas, generar mapas paramétricos de biomarcadores y proporcionar al especialista en radiología esa información decisiva para la identificación, localización y caracterización de los tumores.
Fuente: Kenko Imalytics / Alive Comunicación
Kenko BreastAI+ plasma la situación real de las pacientes a través de los biomarcadores de imagen que el clínico puede interpretar sin dificultad, y que pueden ser muy útiles también para compartir con los departamentos de anatomía patológica y oncología. Todo, con el objetivo de tomar decisiones mucho más personalizadas en cuanto a diagnóstico y tratamiento.
Aceleradora Unoentrecienmil
Por último, la Fundación Unoentrecienmil, dedicada a impulsar proyectos de investigación contra la leucemia infantil, lanza la aplicación Aceleradora Unoentrecienmil para que los niños enfermos de cáncer puedan hacer ejercicio físico desde casa, tutelado y controlado por un terapeuta. Gracias a esta aplicación para móviles, niños y adolescentes pueden seguir su tratamiento complementario de práctica de ejercicio físico desde cualquier sitio y, así, no interrumpir el programa de entrenamiento que se diseña específicamente para ellos desde la Aceleradora Unoentrecienmil en el Hospital La Paz de Madrid.
Con la nueva herramienta, se mejora la adherencia al deporte de estos pequeños, ya que en los periodos que pasan en casa les cuesta más mantener el ritmo de entrenamiento pautado. Se trata de una app específicamente creada para estos pacientes pediátricos, exclusiva y única, a la que sólo pueden acceder ellos y que, además, a largo plazo, les crea un hábito de vida saludable.
Fuente: Fundación Unoentrecienmil / Acento en la Cé
Referencias
1. López de Alba E, Salguero I, Giménez-Llorente D, Montes-Torres J, Fernández-Sanromán A, Casajús-Pelegay E, et al. A comprehensive genetic catalog of human double-strand break repair. Science. 2025. DOI: 10.1126/science.adr5048
2. ZEPZELCA (lurbinectedin) Prescribing Information. Palo Alto, CA: Jazz Pharmaceuticals, Inc.




