Redacción Farmacosalud.com
Lilly anuncia que la Agencia de Medicamentos de Estados Unidos (FDA) ha aprobado una actualización de la ficha técnica con la recomendación de un ajuste en el régimen de dosificación para donanemab, la terapia mensual antiamiloide para adultos con enfermedad de Alzheimer sintomática temprana, es decir, personas con deterioro cognitivo leve o demencia leve debido a la enfermedad de Alzheimer con patología amiloide cerebral confirmada1,2. En el estudio TRAILBLAZER-ALZ 6, el ajuste redujo significativamente la incidencia de anomalías de imagen relacionadas con amiloide con edema/efusión (ARIA-E) frente a la pauta original a las 24 y 52 semanas, alcanzando niveles similares de eliminación de placas amiloides y reducción de P-tau217.
El nuevo régimen implica una dosificación más gradual, de tal manera que TRAILBLAZER-ALZ 6 demostró una disminución significativa de la incidencia de ARIA-E del 41% a las 24 semanas y del 35% a las 52 semanas, en comparación con el régimen original. Las ARIA-E son un efecto adverso de las terapias dirigidas a las placas amiloides, incluyendo donanemab. Generalmente, las ARIA son asintomáticas, aunque pueden producirse eventos adversos graves e incluso mortales.
Autor/a de la imagen: inuella
Fuente: depositphotos.com
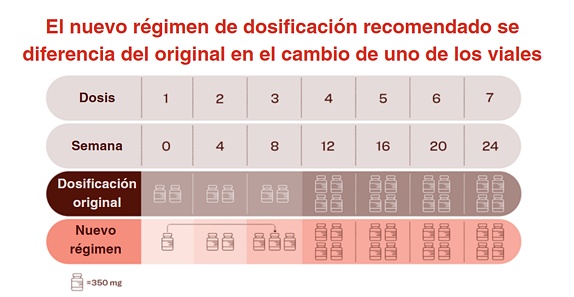
La diferencia del nuevo régimen de dosificación con la pauta original radica en pasar uno de los dos viales de la primera dosis a la tercera dosis, administrándose la misma cantidad total de donanemab antes de la semana 24. Este cambio resultó en menores tasas de ARIA-E sin comprometer la capacidad de donanemab para aclarar las placas amiloides ni tampoco la dosificación mensual del tratamiento de duración potencialmente limitada en el caso de reducir las placas amiloides a niveles mínimos3-6.
Principales hallazgos del ensayo TRAILBLAZER-ALZ 6 que respaldan esta actualización de la ficha técnica:
• El objetivo principal del estudio fue la proporción de participantes con, al menos, un acontecimiento de ARIA-E para la semana 24. Los resultados han demostrado que la incidencia de ARIA-E fue de un 14% en pacientes con el nuevo régimen de dosificación frente al 24% con la pauta original, lo que supone una reducción del riesgo relativo del 41%7. A la semana 52, las tasas fueron del 16% y 25%, respectivamente, con una disminución del riesgo relativo del 35%.
• Los acontecimientos de ARIA asintomáticos observados en la semana 52 incluyeron ARIA total, ARIA-E y ARIA-H en el 29%, 16% y 25% de los enfermos con el nuevo régimen de dosificación, respectivamente. ARIA-E y ARIA-H son tipos diferentes de anomalías en imágenes relacionadas con amiloide (ARIA). La ARIA con edema se denomina ARIA-E y la ARIA con hemorragia o depósito de hemosiderina se denomina ARIA-H.
• Los pacientes con el nuevo régimen de dosificación experimentaron reducciones de placa amiloide y P-tau217 comparables a los de la pauta original. Según lo observado mediante PET amiloide en el criterio de valoración principal a las 24 semanas del estudio TRAILBLAZER-ALZ 6, los sujetos con el nuevo régimen de dosificación de donanemab redujeron sus niveles de placa amiloide un 67% promedio respecto al valor inicial, en comparación con el 69% de los pacientes que recibieron la dosificación original7,8.
• No se identificaron nuevas reacciones adversas en este estudio, aunque se observaron tasas más altas de reacciones de hipersensibilidad y reacciones relacionadas con la infusión.
“Esta nueva estrategia de dosificación representa un avance significativo para los pacientes y los profesionales que los atienden”, declara la Dra. Elly Lee, directora médica e investigadora principal del Irvine Center for Clinical Research (California, en Estados Unidos). “Al reducir significativamente el riesgo de ARIA-E, podemos ofrecer mayor confianza en la seguridad de donanemab sin comprometer su eficacia para reducir las placas de amiloide”, agrega.
Fuente: Lilly / Cícero Comunicación
Donanemab ralentiza significativamente el deterioro cognitivo y funcional
La FDA aprobó donanemab en julio de 2024 basándose en los datos del estudio de fase 3 TRAILBLAZER-ALZ 2, que demostró que donanemab ralentiza significativamente el deterioro cognitivo y funcional en pacientes menos avanzados patológicamente hasta en un 35%, y en un 22% en la población total del estudio, en comparación con placebo, a los 18 meses. Donanemab redujo en un 37% el riesgo de progresión a la siguiente etapa clínica de la enfermedad en el mismo periodo. El deterioro cognitivo y funcional se caracterizó por problemas más graves de memoria y pensamiento, mayores dificultades en las actividades diarias y mayor necesidad de ayuda por parte de cuidadores3,9,10.
En Europa, el Comité de Medicamentos de Uso Humano (CHMP, por sus siglas en inglés) de la Agencia Europea de Medicamentos (EMA, por sus siglas en inglés) emitió el 27 de marzo de 2025 una opinión en la que recomendaba no conceder la autorización de comercialización a donanemab para el tratamiento de adultos en fases tempranas sintomáticas de la enfermedad de Alzheimer. En la actualidad, donanemab se encuentra en fase de reevaluación por parte de este organismo regulador a instancias de la compañía.
Donanemab es una terapia dirigida al amiloide para personas con deterioro cognitivo leve (DCL) así como para personas en la etapa leve de demencia de la enfermedad de Alzheimer sintomática temprana, con patología amiloide confirmada. Se administra por vía intravenosa y está disponible en viales monodosis de 350 mg/20 mL. Donanemab puede causar efectos secundarios graves, incluidas anomalías en imágenes relacionadas con amiloide (ARIA) y reacciones relacionadas con la infusión.
Monitorización continua y precisa de la Miastenia Gravis

Fuente: Argenx / Torres y Carrera
La monitorización remota y continua de los síntomas de la Miastenia Gravis (MG) es esencial para garantizar un seguimiento preciso de los pacientes con esta enfermedad neuromuscular rara, autoinmune y crónica, que cursa con debilidad muscular de carácter fluctuante. Con este objetivo nace la aplicación myMGverse11, una innovadora herramienta diseñada para que las personas con esta patología puedan autoevaluar sus síntomas relacionados con la afección de una forma sencilla, así como compartir los datos con su neurólogo, permitiendo de este modo un manejo más ágil y personalizado de la enfermedad.
La compañía biotecnológica argenx ha colaborado en el desarrollo de esta aplicación como parte de su compromiso con la mejora de la calidad de vida de las personas con MG. La Dra. Elena Cortés, neuróloga de la Unidad de Enfermedades Neuromusculares del Hospital de la Santa Creu i Sant Pau de Barcelona, destaca la relevancia de esta herramienta: “la Miastenia Gravis es una enfermedad, por definición, fluctuante, y los pacientes pueden presentar exacerbaciones entre visita y visita con su neurólogo. En este sentido, es fundamental realizar un seguimiento y monitorización estrecha, ya que la aparición de estos síntomas tiene implicaciones a nivel terapéutico que se deben implementar lo antes posible, y la aplicación myMGverse nos da esa posibilidad, ayudando a detectar síntomas o exacerbaciones de una manera precoz”.
Referencias
1. Kisunla (donanemab-azbt). Prescribing Information. Lilly USA, LLC.
2. Kisunla (donanemab-azbt). Medication Guide. Lilly USA, LLC.
3. Sims JR, Zimmer JA, Evans CD, et al. Donanemab in Early Symptomatic Alzheimer Disease: The TRAILBLAZER-ALZ 2 Randomized Clinical Trial. JAMA. 2023;330(6):512-527. doi:10.1001/jama.2023.13239.
4. Ross EL, Weinberg MS, Arnold SE. Cost-effectiveness of Aducanumab and Donanemab for Early Alzheimer Disease in the US. JAMA Neurol. 2022;79(5):478-487. doi:10.1001/jamaneurol.2022.0315.
5. Boustani M, Doty EG, Garrison LP Jr, et al. Assessing the Cost-effectiveness of a Hypothetical Disease-modifying Therapy With Limited Duration for the Treatment of Early Symptomatic Alzheimer Disease. Clin Ther. 2022;44(11):1449-1462. doi:10.1016/j.clinthera.2022.09.008.
6. Mattke S, Ozawa T and Hanson M. Implications of Treatment Duration and Intensity on the Value of Alzheimer's Treatments. Clinical Trials on Alzheimer's Disease. Oct. 24-27, 2023.
7. Wang H, Monkul Nery ES, Ardayfio P, et al. (2025). 21(4). https://doi.org/10.1002/alz.70062
8. Data on File. Lilly USA, LLC. DOF-DN-US-0069
9. Data on File. Lilly USA, LLC. DOF-DN-US-0053.
10. 2024 Alzheimer's disease facts and figures. Alzheimers Dement. 2024 May;20(5):3708-3821. doi: 10.1002/alz.13809. Epub 2024 Apr 30. PMID: 38689398; PMCID: PMC11095490.
11. https://www.mymgverseapp.com/




