La psoriasis es una enfermedad inflamatoria crónica de la piel, caracterizada por la presencia de placas eritematosas y descamativas que afectan comúnmente el cuero cabelludo, las zonas de extensión de extremidades y el tronco. Se considera una enfermedad autoinmune en la que el sistema inmunológico ataca de forma anormal a los tejidos de la piel, lo que genera una respuesta inflamatoria exacerbada. Por otro lado, la denominación Enfermedad Inflamatoria Intestinal, que se abrevia frecuentemente como EII, se emplea para referirse a una serie de problemas que afectan predominantemente al intestino y que se caracterizan por producir una inflamación crónica de origen autoinmune que no tiende a la curación. La EII se divide en 2 enfermedades: la enfermedad de Crohn y la colitis ulcerosa. Estas son enfermedades inflamatorias que cursan en brotes y que tienden a la cronificación, y que afectan el tracto gastrointestinal con episodios de inflamación con dolor y diarrea, con potenciales complicaciones graves, como perforación intestinal o sepsis. Ambas afecciones comparten mecanismos inmunológicos con la psoriasis, y existe evidencia que sugiere una asociación entre la psoriasis y las EII, en la cual ambas enfermedades pueden coexistir en un mismo paciente y compartir factores genéticos y de respuesta inmune alterada1.

Prof. Pedro Rodríguez Jiménez
Fuente: Prof. Rodríguez Jiménez / Real Academia Nacional de Medicina de España (RANM)
Uno de los principales mecanismos comunes entre la psoriasis y las EII es la activación de la inmunidad innata y adaptativa. En ambas patologías se ha observado una activación de las células T, especialmente las células Th17 y Th1, que juegan un papel crucial en la liberación de citocinas proinflamatorias, como la interleucina-17 (IL-17) y el factor de necrosis tumoral alfa (TNF-α). Estas citocinas contribuyen a la inflamación crónica en los tejidos afectados, tanto en la piel como en el tracto gastrointestinal2.
Además, la microbiota intestinal parece desempeñar un rol fundamental en la regulación de estas enfermedades. En individuos con psoriasis y EII, se ha encontrado una alteración en la composición de dicha microbiota, lo que puede aumentar la permeabilidad intestinal y contribuir a la inflamación sistémica. Algunos estudios indican que las bacterias intestinales pueden modular la respuesta inmune y agravar la inflamación en ambas enfermedades3.
La predisposición genética también desempeña un papel en la relación entre psoriasis y EII. Variantes genéticas en ciertos loci (regiones de un cromosoma), como el HLA-Cw6, han sido asociadas tanto con la psoriasis como con la enfermedad de Crohn. Además, el gen IL23R, que codifica el receptor de la interleucina-23, está implicado en la regulación de la respuesta de las células Th17, y se ha relacionado tanto con la psoriasis como con las EII4. Esto sugiere que algunas personas tienen una predisposición genética para desarrollar ambas condiciones debido a alteraciones en las vías inmunológicas compartidas.
Es común que las personas con psoriasis presenten síntomas gastrointestinales, mientras que los pacientes con EII pueden manifestar síntomas cutáneos. Estudios epidemiológicos muestran que los pacientes con psoriasis tienen un mayor riesgo de desarrollar EII en comparación con la población general. En un estudio de cohorte, se observó que el riesgo de desarrollar enfermedad de Crohn en pacientes con psoriasis era aproximadamente 1.7 veces mayor, mientras que el riesgo de colitis ulcerosa era aproximadamente 1.3 veces mayor5. Esta relación sugiere que los médicos deben estar atentos a la posibilidad de observar síntomas de EII en pacientes con psoriasis y viceversa.
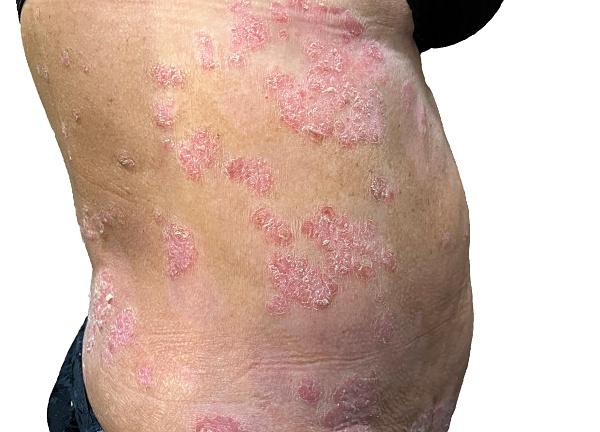
Un caso de psoriasis
Autor/a de la imagen: Gatilovs
Fuente: depositphotos.com
El manejo de estas comorbilidades requiere una atención multidisciplinaria, ya que algunos tratamientos pueden ser efectivos para ambas enfermedades. Por ejemplo, los inhibidores del TNF-α, como el infliximab y el adalimumab, han mostrado eficacia en el tratamiento tanto de la psoriasis como de las EII6. Sin embargo, otros medicamentos, como los inhibidores de IL-17, son efectivos para la psoriasis pero pueden exacerbar los síntomas de las EII, lo que plantea desafíos en el tratamiento combinado7, y en la misma línea, los inhibidores del TNF-α pueden provocar en pacientes con EII, paradójicamente, brotes de psoriasis.
En conclusión, la relación entre psoriasis y EII se basa en mecanismos inmunológicos y genéticos compartidos, de manera que su coexistencia en los pacientes requiere de un manejo cuidadoso. La investigación en torno a esta relación sigue avanzando, buscando identificar tratamientos que permitan un control efectivo de ambas enfermedades y minimicen los efectos adversos.
Referencias
1. Eppinga H, Poortinga S, Thio HB, Nijsten TE, Konstantinov SR. Similar depletion of protective bacterial species in psoriasis and inflammatory bowel disease. Scientific Reports. 2017;7(1):1-9.
2. Zhu TH, Nakamura M, Farahnik B. The role of IL-17 in the pathogenesis of psoriasis and inflammatory bowel disease. Journal of Dermatological Science. 2019;96(2):151-155.
3. Takeshita J, Grewal S, Van Voorhees AS. Psoriasis and comorbidities: links between immune response and inflammation. The Lancet. 2017;390(10111):231-243.
4. Li Q, Chen L, Jiang Q. Association of IL23R and HLA-C gene polymorphisms with psoriasis and inflammatory bowel disease: A meta-analysis. PloS one. 2017;12(4), e0173736.
5. Egeberg A, Mallbris L, Gislason GH, Hansen PR, Mrowietz U. Risk of inflammatory bowel disease in patients with psoriasis: A Danish nationwide cohort study. Journal of Investigative Dermatology. 2016;136(1): 93-98.
6. Gisondi P, Del Giglio M, Di Francesco V, Zattra E. Inflammatory bowel disease and psoriasis: The Janus faces of TNF‐α inhibitors. British Journal of Dermatology. 2016;175(3):463-464.
7. Strober B, Gottlieb AB, Gisondi P. Immunological mechanisms in comorbid inflammatory diseases. Nature Reviews Rheumatology. 2018;14(10):613-615.




