Dr. Federico Argüelles Arias / Dra. Teresa Valdés Delgado
Introducción:
La Enfermedad Inflamatoria Intestinal (EII) es una patología crónica, inmunomediada, que incluye básicamente a dos entidades: la colitis ulcerosa (CU) y la enfermedad de Crohn (EC)1. Cada una de ellas cuenta con características clínicas e histopatológicas propias. No obstante, en ocasiones, se superponen rasgos de ambas patologías, siendo difícil establecer un diagnóstico definitivo; se habla en estos casos de colitis indeterminada. Característicamente, cursan por periodos de actividad (brotes) y remisión de la enfermedad2.
La incidencia y prevalencia de la CU y EC ha ido aumentando progresivamente desde que fueron descritas por primera vez en 1875 y 1932, respectivamente. Así, por ejemplo, en nuestra área se ha multiplicado la incidencia de EII por dos en las dos primeras décadas de este siglo frente al siglo XX3. Por otro lado, clásicamente, la EII se ha considerado una enfermedad que afecta a jóvenes, ya que el debut de la EII sucede con mayor frecuencia entre los 15-30 años.

Dr. Federico Argüelles Arias y Dra. Teresa Valdés Delgado
Fuente: Drs. Argüelles y Valdés
No obstante, también se ha descrito un segundo pico de incidencia en torno a los 60-80 años4. Recientemente, se ha comunicado que, aproximadamente, un 10-15% de los nuevos casos de EII ocurren en pacientes mayores de 60 años, con una incidencia estimada de 18.9 por 100.000 habitantes y año5. Es más, para la década que viene se estima que un tercio de los pacientes con EII serán mayores de esta edad6. Esto es debido, por un lado, al debut de la enfermedad en edades tardías de la vida, pero también debido al envejecimiento de la población que atendemos actualmente. En cualquier caso, en este grupo etario, también es importante tener en cuenta que el diagnóstico, y no sólo el seguimiento de la EII, es complejo debido a que el diagnóstico diferencial de la EII en edades tardías implica un abanico mayor de patologías.
Características de la EII en pacientes mayores:
Según la Sociedad Europea para el estudio de la Enfermedad de Crohn y Colitis Ulcerosa (ECCO), paciente mayor es aquel que tenga igual o más de 60 años, si bien aclara que la fragilidad es algo a tener muy en cuenta7. Ésta se define como un estado clínico, asociado a la edad, con una disminución de la reserva fisiológica y de la función en múltiples órganos y sistemas, lo que confiere una disminución en la capacidad para hacer frente a factores estresantes crónicos o agudos, y una mayor vulnerabilidad ante los mismos8. Esto, evidentemente, se asocia con un mayor riesgo de complicaciones tras distintos procesos clínicos coincidentes y así, aunque no siempre, un paciente mayor de 60 años es más frágil que uno de 40 que presente múltiples patologías.
Aunque se pudiera pensar que la EII se manifiesta de la misma manera en pacientes mayores, está demostrado que esto no es así. Existe una serie de diferencias entre los pacientes con menor y mayor edad con EII. En los pacientes muy jóvenes, el fenotipo inflamatorio suele ser el inicial, pero con el paso del tiempo la enfermedad se agrava y aparecen estenosis y fístulas. En este grupo de personas, la genética juega un papel fundamental, ya que, por la edad del paciente, los factores ambientales aún no han influido en el desarrollo de la inflamación intestinal.
Sin embargo, en los pacientes de mayor edad, la enfermedad no suele tener un perfil tan agresivo; el fenotipo inflamatorio suele ser el predominante y la evolución a un perfil más grave es más lenta. En este caso, la genética juega un papel secundario y los factores ambientales (tabaco, estrés, malos hábitos dietéticos y alteración de la microbiota) sí influyen de forma más predominante en el desarrollo de la enfermedad9. Además, a diferencia de la localización habitual (ileo-colónica), en la mayoría de los pacientes con EC es más frecuente la afectación colónica, y la localización izquierda en la CU10. A todo esto, se une la presencia de comorbilidades asociadas (como hipertensión, diabetes, cardiopatías, antecedentes de neoplasia) que, obviamente, dificultan el tratamiento y obligan al especialista a individualizar el abordaje terapéutico y prestar especial atención a estos factores.
Manejo de la EII en la población mayor:
Como ya se ha comentado el paciente mayor es, de facto, vulnerable, y a la hora de elegir un tratamiento para controlar su enfermedad debemos seleccionar aquel que tenga menos eventos adversos de forma global, y más específicamente en este grupo11.
Aunque en la práctica clínica habitual se usen los corticoides para controlar los brotes de la EII (si bien debemos utilizarlos lo menos posible en general), éstos tienen efectos secundarios que, en la edad avanzada o en el paciente frágil, suelen ser más graves. Si el enfermo padece diabetes mellitus, los corticoides la empeoran; si padece osteoporosis, los corticoides facilitan las fracturas; empeoran las cataratas, la tensión arterial y, muy importante, aumentan los procesos infecciosos (2,3 veces más riesgo que en pacientes no expuestos)12.
En la Figura 1 se expone la pirámide de seguridad de los fármacos empleados en la EII; los corticoides se sitúan en la base por ser los menos seguros. Por el contrario, se sabe que los aminosalicilatos son fármacos con un perfil de seguridad muy bueno, por lo que se utilizan sin mayores problemas, especialmente en la CU, aunque es preceptivo vigilar la función renal13. Distinto es el perfil de seguridad de los inmunosupresores, entendiendo por esta denominación a la azatioprina y al metotrexate. Hasta un 10-15% de los pacientes abandonan estos medicamentos por efectos adversos que incluyen intolerancia digestiva, pancreatitis y aplasia medular (que es el más temido)14. En nuestro grupo de pacientes, sin duda alguna, además de estos, los más importantes son los cuadros infecciosos, trastornos linfoproliferativos y los cánceres de piel no melanocíticos15.
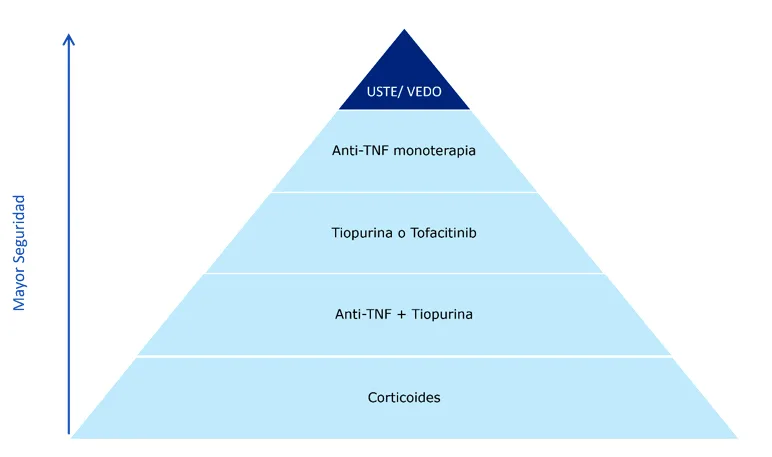
Figura 1. Pirámide de seguridad de los tratamientos en la EC
Tomado de: Click B, Regueiro M. A Practical Guide to the Safety and Monitoring of New IBD Therapies. Inflamm Bowel Dis. 2019; 25(5): 831-842.
Especial atención merecen los fármacos biológicos, que se utilizan en los procesos de mayor gravedad. La aparición de este tipo de medicamentos ha supuesto una notable repercusión en la historia natural de la enfermedad y una revolución en el tratamiento. Dentro de este grupo de biológicos, los primeros fármacos en aparecer fueron los anti-TNF, que actúan bloqueando el TNFα, uno de los mediadores principales de la cascada inflamatoria. Tanto Infliximab como Adalimumab constituyen los fármacos más empleados y están indicados para la inducción y el mantenimiento en la EC y la CU16,17.
Los biológicos se caracterizaban por presentar un coste elevado en los primeros años, pero la llegada de los biosimilares a partir de 2015 y la reducción de su precio ha permitido incrementar su uso de forma generalizada. Aunque eficaces, no carecen de efectos adversos que son, principalmente, las infecciones18. En este punto, debemos destacar que hay múltiples estudios que advierten que, en la población mayor, la incidencia de estos cuadros infecciosos es superior19. Incluso, hay algún estudio que concluye que, per se, simplemente por la edad, estos pacientes van a responder peor a estos medicamentos20. Además, como es sabido, por el desarrollo de anticuerpos que, secundariamente, inducen pérdida de respuesta, se les suelen asociar un inmunosupresor, lo que aumenta la tasa de efectos adversos. Por todo ello, aunque eficaces, estos fármacos no debieran ser utilizados en primera línea en este grupo de pacientes.
Recientemente, se han incorporado a este arsenal terapéutico nuevos fármacos que actúan sobre otras dianas terapéuticas: anti-interleuquinas y anti-integrinas. Si bien habitualmente se emplean en segunda y tercera línea, su perfil de seguridad es mayor al poseer un mecanismo de acción más selectivo. Es por esto por lo que suelen emplearse cuando existen contraindicaciones a los anti-TNF, como son los casos de edad avanzada, antecedentes de cáncer reciente, infecciones graves, y enfermedades desmielinizantes o insuficiencia cardíaca, entre otras21. En comparación con el resto de los fármacos biológicos, representan el grupo más seguro y, por tanto, de elección.

Autor/a de la imagen:Thirdman
Fuente: Pexels (free photo)
Ustekinumab es un anticuerpo monoclonal IgG1 totalmente humanizado dirigido frente a la subunidad p40 de las IL 12 y 23, impidiendo su unión a los receptores de superficie celular, con lo que inhibe la respuesta inmune mediada por ellos. Está aprobado como tratamiento de inducción y mantenimiento de adultos con CU y EC activas de moderadas a graves que hayan tenido respuesta inadecuada, pérdida de respuesta, contraindicaciones o intolerancia al tratamiento convencional o anti-TNF. Se administra una dosis única de inducción intravenosa de 6 mg/kg (260 mg si <55 kg, 390 mg si 55-85 kg o 420 mg si >85kg), seguida de dosis subcutáneas de mantenimiento con 90 mg cada 8 o 12 semanas22. En los ensayos pivotales23, Ustekinumab demostró su superioridad respecto a placebo como tratamiento de inducción y mantenimiento de la EC, con un buen perfil de seguridad y baja inmunogenicidad. Recientemente, nuestro grupo ha publicado un trabajo en el que se demuestra la seguridad y gran eficacia de este fármaco en pacientes que, previamente, no habían recibido ningún biológico, y con una edad media de 60 años24.
Vedolizumab es un anticuerpo monoclonal humanizado tipo IgG1 que actúa bloqueando una integrina (α4β7) que se encuentra en la superficie de aquellos linfocitos T colaboradores que se desplazan hacia la mucosa gastrointestinal y que se unen a MadCAM-1, una proteína expresada en el endotelio de intestino y colon. De esta forma, impediría el reclutamiento de los leucocitos a nivel intestinal, por lo que se considera un fármaco muy selectivo y específico del intestino. Tras haber demostrado más eficacia que placebo en los estudios pivotales GEMINI25,26, se aprobó por la FDA y la EMA (Agencia del Medicamento de Estados Unidos y Europa, respectivamente) en el año 2014 para el tratamiento de pacientes con EC y CU que presenten un fracaso previo, contraindicación o intolerancia a los tratamientos convencionales. Su presentación es a través de una solución inyectable de 300 mg vía intravenosa a las 0, 2 y 6 semanas, posteriormente cada 8 de mantenimiento. Al igual que Ustekinumab, su perfil de seguridad es muy bueno, con una muy baja o nula inmunogenicidad, lo que le confiere un lugar preponderante en los casos en los que estén contraindicados los anti-TNF o su uso pueda suponer mayor riesgo.
Recientemente comercializado, Risankizumab es un inhibidor selectivo de la IL-23 (subunidad p19) que ha demostrado superioridad en estudios frente a placebo para EC activa de moderada a grave en casos que habían presentado intolerancia o respuesta inadecuada a uno o más productos biológicos aprobados o a terapia convencional (ADVANCE/MOTIVATE)27 y en mantenimiento (FORTIFY)28. La dosis de inducción de Risankizumab es 600 mg vía intravenosa en la semana 0, 4 y 8, y posteriormente se administraría 360 mg vía subcutánea en la semana 12 y cada 8 semanas de mantenimiento. Su perfil de seguridad es similar a Ustekinumab y Vedolizumab, por lo que, a falta de ir cogiendo experiencia con él, se perfila como un fármaco también de primera línea.

Autor/a de la imagen: Enric Arandes
Fuente: E. Arandes / www.farmacosalud.com
Por último, los inhibidores de la JAK-kinasa son pequeñas moléculas orales de síntesis química. Disponemos de Tofacitinib, que actúa inhibiendo la JAK 1, JAK 2, JAK 3 y en menor medida, la TYK2; de Filgotinib, que es un inhibidor selectivo de la JAK 1, y de Upadacitinib, que también es un inhibidor selectivo de la JAK 1. Este último es el único aprobado para la EC y va a ser comercializado en breve. El problema de estos medicamentos es que, aunque muy efectivos, están contraindicados en pacientes mayores de 65 años, principalmente por su mayor riesgo de tromboembolismo venoso (TEV) y eventos cardiovasculares importantes29.
En resumen, la población mayor o frágil con EII debe ser especialmente seguida y tratada con los fármacos más seguros. En este sentido, los aminosalicilatos y los fármacos biológicos Ustekinumab, Vedolizumab y Risankizumab, son los de elección para este grupo de pacientes por su excelente perfil de seguridad.
Bibliografía
1. Hinojosa del Val J. Definiciones y clasificación. En: Gomollón García F, Hinojosa del Val J, Gassull Duró MÀ, editores. Enfermedad Inflamatoria Intestinal. 4o. Madrid: Ergon; 2019. p. 3-10.
2. Lee KS, Medline A, Shockey S. Indeterminate colitis in the spectrum of inflammatory bowel disease. Arch Pathol Lab Med. 1979; 103(4):173-6.
3. Chaaro Benallal D, Guerra Veloz MF, Argüelles-Arias F, et al. Evolution of the incidence of inflammatory bowel disease in Southern Spain. Rev Esp Enferm Dig. 2017; 109(11): 757-760.
4. Bernstein CN. Review article: changes in the epidemiology of inflammatory bowel disease clues for aetiology. Aliment Pharmacol Ther. 2017; 46(10):911-9.
5. Singh S, Underwood F, Loftus EV, et al. Worldwide Incidence of Older-Onset Inflammatory Bowel Diseases in the 21st Century: A Systematic Review of Population-Based Studies. Gastroenterology 2019; 156: S394–S395.
6. Coward S, Clement F, Benchimol EI, et al. Past and Future Burden of Inflammatory Bowel Diseases Based on Modeling of Population-Based Data. Gastroenterology 2019; 156: 1345–1353.
7. Sturm A, Maaser C, Mendall M, et al. European Crohn's and Colitis Organisation Topical Review on IBD in the Elderly. J Crohns Colitis. 2017; 11(3): 263-273.
8. Acosta-Benito MÁ, Martín-Lesende I. Fragilidad en atención primaria: diagnóstico y manejo multidisciplinar [Frailty in primary care: Diagnosis and multidisciplinary management]. Aten Primaria. 2022; 54(9): 102395.
9. Ruel J, Ruane D, Mehandru S, et al. IBD across the age spectrum: is it the same disease? Nat Rev Gastroenterol Hepatol. 2014; 11(2): 88-98.
10. Charpentier C, Salleron J, Savoye G, et al. Natural history of elderly-onset inflammatory bowel disease: a population-based cohort study. Gut. 2014; 63(3): 423-32.
11. Huang X, et al. Prevalence of frailty among patients with inflammatory bowel disease and its association with clinical outcomes: a systematic review and meta-analysis. BMC Gastroenterol. 2022;22(1):534.
12. Brassard P, Bitton A, Suissa A, et al. Oral corticosteroids and the risk of serious infections in patients with elderly-onset inflammatory bowel diseases. Am J Gastroenterol. 2014; 109(11): 1795-802.
13. Muller AF, Stevens PE, McIntyre AS, et al. Experience of 5-aminosalicylate nephrotoxicity in the United Kingdom. Aliment Pharmacol Ther. 2005 May 15;21(10):1217-24.
14. Chaparro M, Ordás I, Cabré E, et al. Safety of thiopurine therapy in inflammatory bowel disease: long-term follow-up study of 3931 patients. Inflamm Bowel Dis. 2013; 19(7): 1404-10.
15. Bermejo F, Aguas M, Chaparro M, et al. Recommendations of the Spanish Working Group on Crohn’s Disease and Ulcerative Colitis (GETECCU) on the use of tiopurines in inflammatory bowel disease. Gastroenterol Hepatol. 2018; 41(3): 205-21.
16. Hanauer SB, Feagan BG, Lichtenstein GR, et al. Manteniance infliximab in Crohn’s disease: The ACCENT I randomised trial. Lancet. 2002; 359(9317): 1541-9.
17. Rutgeerts P, Sandborn WJ, Feagan BG, et al. Infliximab for induction and maintenance therapy for ulcerative colitis. N Engl J Med. 2005; 353(23): 2462-76.
18. Lobatón T, Ferrante M, Rutgeerts P, et al. Efficacy and safety of anti-TNF therapy in elderly patients with inflammatory bowel disease. Aliment Pharmacol Ther. 2015; 42(4): 441-51.
19. Kochar B, Cai W, Cagan A, Ananthakrishnan AN. Pretreatment Frailty Is Independently Associated With Increased Risk of Infections After Immunosuppression in Patients With Inflammatory Bowel Diseases. Gastroenterology. 2020; 158(8): 2104-2111.
20. Fidder H, Schnitzler F, Ferrante M, et al. Long-term safety of infliximab for the treatment of inflammatory bowel disease: a single-centre cohort study. Gut. 2009 Apr;58(4):501-8.
21. Clement B, De Felice K, Afzali A. Indications and safety of newer IBD treatments in the older patient. Curr Gastroenterol Rep. 2023; 25(7): 160-168.
22. European Medicines Agency - European public assessment reports – Ustekinumab [Internet]. 2021. Disponible en: https://www.ema.europa.eu/en/documents/product-information/stelara-epar-product-information_en.pdf
23. Feagan BG, Sandborn WJ, Gasink C, et al. Ustekinumab as Induction and Maintenance Therapy for Crohn’s Disease. N Engl J Med. 2016; 375(20): 1946-60.
24. Valdés T, Olmedo R, Iborra M, et al. Effectiveness and safety of ustekinumab in bio-naïve Crohn's disease patients: a multicentre observational retrospective study. Therap Adv Gastroenterol. 2023; 16: 17562848231153560.
25. Sandborn WJ, Feagan BG, Rutgeerts P, et al. Vedolizumab as induction and maintenance therapy for Crohn’s disease. N Engl J Med. 2013; 369(8):711–21.
26. Loftus EV, Feagan BG, Panaccione R, et al. Long-term safety of vedolizumab for inflammatory bowel disease. Aliment Pharmacol Ther. 2020; 52(8):1353–65.
27. D'Haens G, Panaccione R, Baert F, et al. Risankizumab as induction therapy for Crohn's disease: results from the phase 3 ADVANCE and MOTIVATE induction trials. Lancet. 2022; 399(10340): 2015-2030.
28. Ferrante M, Panaccione R, Baert F, et al. Risankizumab as maintenance therapy for moderately to severely active Crohn's disease: results from the multicentre, randomised, double-blind, placebo-controlled, withdrawal phase 3 FORTIFY maintenance trial. Lancet. 2022; 399(10340): 2031-2046.
29. Herrera-de Guise C, Serra-Ruiz X, Lastiri E, Borruel N. JAK inhibitors: A new dawn for oral therapies in inflammatory bowel diseases. Front Med (Lausanne). 2023; 10: 1089099.





