Redacción Farmacosalud.com
Novartis comunica que el Comité de Medicamentos de Uso Humano (CHMP) de la Agencia Europea de Medicamentos ha adoptado una decisión positiva y ha recomendado conceder la autorización de comercialización para Cosentyx® (secukinumab) en pacientes adultos con hidradenitis supurativa (HS) activa moderada-grave1.
“La HS es una enfermedad inflamatoria dermatológica con un tratamiento insuficiente y habitualmente observo su impacto devastador en mi práctica clínica diaria. Necesitamos más opciones que puedan abordar sus múltiples signos y síntomas, especialmente los abscesos, el dolor y la cicatrización, y que proporcionen resultados rápidos y duraderos”, comenta el catedrático Christos C Zouboulis, presidente de la European Hidradenitis Suppurativa Foundation, director de los Departamentos de Dermatología, Venereología, Alergología e Inmunología, Staedtisches Klinikum Dessau y Prof. fundador de Dermatología y Venereología en la Facultad de Medicina de Brandenburgo, Alemania. "Las novedades presentadas son esperanzadoras en cuanto a disponer pronto de una nueva opción terapéutica para ofrecer a nuestros pacientes en Europa", agrega.
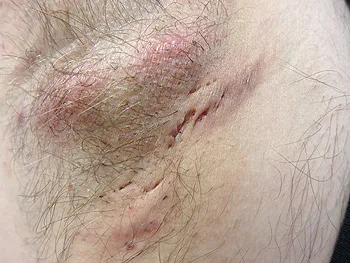
Hidradenitis supurativa en axila derecha de un paciente en estadio II
Autor/a de la imagen: Dr. Thomas Brinkmeier
File:Acne inversa mit Abszess, Hurley-Stadium II, ©WIKDERM
Fuente: Wikipedia
“Es humillante depender de alguien para que me ayude a atarme los cordones de los zapatos”
“El dolor que me provoca la HS puede ser en ocasiones insoportable, lo que limita mi capacidad para realizar actividades diarias como vestirme, bañarme, caminar, hacer ejercicio, cocinar y limpiar. Es humillante depender de alguien para que me ayude a atarme los cordones de los zapatos. Más allá del dolor, el drenaje, la fatiga y otros síntomas de la HS impactan en mis relaciones, intimidad, salud mental, trabajo y economía. Se necesitan nuevas opciones terapéuticas para ayudar a mejorar la vida de las personas con HS”, sostiene el Dr. Barry McGrath, PhD, director ejecutivo en funciones de HS Irlanda.
La HS afecta a 1 de cada 100 personas en todo el mundo5, y en Europa hay alrededor de 200.000 personas que viven actualmente en estadios moderados/graves de la enfermedad6. El impacto de la enfermedad es sustancial, incluso para quienes están en tratamiento, ya que actualmente solo existe un tratamiento biológico aprobado para la HS, pero alrededor del 50% de los pacientes pueden perder la respuesta7. La HS provoca abscesos similares a forúnculos que pueden romperse creando heridas abiertas que pueden provocar cicatrices irreversibles, a menudo en las partes más íntimas del organismo. Los pacientes describen su dolor relacionado con la HS como el síntoma más debilitante, que empeora a medida que aumenta la gravedad de la afección5,8.
SUNSHINE y SUNRISE
La opinión positiva del CHMP se basa en resultados sólidos de dos estudios en el mayor programa de Fase III en HS, SUNSHINE y SUNRISE9,10. Los datos mostraron que las tasas de respuesta al tratamiento continuaron mejorando más allá del análisis del objetivo primario en la semana 16, alcanzando más del 55% de los pacientes una medida de respuesta clínica en HS (HiSCR) en la semana 521. Además, más del 50% de las personas que viven con HS moderada/grave experimentaron una reducción significativa del dolor relacionado con la HS en la semana 521. Los resultados de seguridad fueron consistentes y refuerzan el buen perfil de seguridad de Cosentyx, respaldado por la evidencia clínica durante 8 años de su uso en la práctica clínica real. Los resultados completos se publicaron recientemente en ‘The Lancet’1.
Autor/a: TeemaTuotanto (pixabay.com)
Fuente: www.needpix.com (free photo)
SUNSHINE (NCT03713619) y SUNRISE (NCT03713632) comprenden el programa de Fase III más grande en hidradenitis supurativa (HS), con un reclutamiento combinado de más de 1.000 pacientes en 40 países. SUNSHINE y SUNRISE son estudios idénticos, globales de Fase III, multicéntricos, aleatorizados, doble ciego, controlados con placebo y de grupos paralelos que evaluaron la eficacia, la seguridad y la tolerabilidad a corto (16 semanas) y a largo plazo (hasta 52 semanas) de dos regímenes de dosis de Cosentyx en adultos con HS moderada/grave. Los resultados en la semana 16 mostraron un porcentaje significativamente mayor de pacientes que lograron una respuesta clínica en hidradenitis supurativa (HiSCR) cuando recibieron tratamiento con Cosentyx 300 mg, dosificado cada 2 semanas (después de las dosis de carga semanales estándar), en comparación con el placebo en los estudios SUNSHINE y SUNRISE (45,0% vs. 33,7% [P = 0,0070] y 42,3% vs. 31,2% [P = 0,0149], respectivamente).
La HiSCR se define como una disminución de al menos un 50% en el recuento de abscesos y nódulos inflamatorios (NI) sin aumentar el número de abscesos ni/o los túneles de drenaje. En la semana 16, el grupo del estudio que recibió 300 mg de Cosentyx cada 4 semanas (después de las dosis de carga semanales estándar) fue superior al placebo para lograr HiSCR en el estudio SUNRISE (46,1% vs. 31,2% [P = 0,0022]), aunque este grupo no alcanzó la significación estadística en el estudio SUNSHINE (41,8% vs. 33,7% [P = 0,0418]). Los objetivos secundarios incluyeron el cambio porcentual desde el momento basal en el recuento de NI, el porcentaje de pacientes que experimentaron un brote y el porcentaje de pacientes con una respuesta en la escala de calificación numérica del dolor de piel de 30 después de 16 semanas de tratamiento.
Un análisis exploratorio evaluó los efectos a largo plazo de Cosentyx para cada uno de los objetivos primarios y secundarios durante un máximo de 52 semanas. Los valores de HiSCR observados en la semana 16 después de cualquier régimen de dosis del fármaco mejoraron con el tiempo hasta la semana 52 (SUNSHINE: SECQ2W [56,4%]; SECQ4W [56,3%]; SUNRISE: SECQ2W [65,0%]; SECQ4W [62,2%]), con mejoras rápidas observadas en sujetos que cambiaron del placebo en la semana 16. El perfil de seguridad fue consistente con el de Cosentyx en sus indicaciones existentes.
Primer y único biológico totalmente humano que inhibe directamente la interleuquina-17A
Secukinumab es el primer y único biológico totalmente humano que inhibe directamente la interleuquina-17A, una citoquina fundamental implicada en la inflamación de la artritis psoriásica (APs), la psoriasis en placas moderada/grave, la espondilitis anquilosante (EA) y la espondiloartritis axial no radiográfica (EspAax-nr)11,12. Es un medicamento comprobado y se ha estudiado clínicamente durante más de 14 años, estando amparado por pruebas sólidas, que incluyen 5 años de datos clínicos en adultos, que respaldan la seguridad y la eficacia a largo plazo en la psoriasis en placas moderada/grave, la APs y la EA13-19. Estos datos refuerzan la posición de Cosentyx como tratamiento para la EA, EspAax-nr, PsA, psoriasis en placas moderada/grave (en pacientes adultos y pediátricos) y dos subtipos de artritis idiopática juvenil (AIJ): la artritis relacionada con entesitis y la artritis psoriásica juvenil12.
Más de 1 millón de pacientes han sido tratados con Cosentyx en todo el mundo desde su lanzamiento en 201520. Esta terapia está aprobada en más de 100 países21, y recientemente obtuvo la aprobación para la AIJ en EE. UU. y Europa22,23.
Referencias
1. Kimball AB, Jemec GBE, Alavi A, et al. Secukinumab in moderate to severe hidradenitis suppurativa (SUNSHINE and SUNRISE): week 16 and 52 results of two identical, double-blind, placebo-controlled, phase 3 randomised trials. Lancet 2023; 401: 747–761.
2. Data on file. NCT03713619 and NCT03713632 (SUNSHINE and SUNRISE): Pooled Data Tables. Novartis Pharmaceuticals Corp; 2022.
3. Data on file. NCT03713619 and NCT03713632 (SUNSHINE and SUNRISE): Summary of Clinical Efficacy. Novartis Pharmaceuticals Corp; 2022.
4. Data on file. NCT03713619 and NCT03713632 (SUNSHINE and SUNRISE): Clinical Study Program post-hoc analysis of skin pain NRS severity. Novartis Pharmaceuticals Corp; 2022.
5. MedLine Plus. Hidradenitis suppurativa [online]. Available at: https://medlineplus.gov/genetics/condition/hidradenitis-suppurativa/ [Last accessed: April 2023].
6. Data on file. Novartis Pharmaceuticals Corp; March 2023.
7. Kimball AB, Okun MM, Williams DA, et al. Two Phase 3 Trials of Adalimumab for Hidradenitis Suppurativa. N Engl J Med 2016; 375: 422–434.
8. Sabat R, Jemec GBE, Matusiak L, et al. Hidradenitis suppurativa. Nat Rev Dis Primers 2020; 6: 18.
9. ClinicalTrials.gov. Study of Efficacy and Safety of Two Secukinumab Dose Regimens in Subjects With Moderate to Severe Hidradenitis Suppurativa (HS) (SUNRISE). NCT03713632. Available at: https://clinicaltrials.gov/ct2/show/NCT03713632 [Last accessed: April 2023].
10. ClinicalTrials.gov. This is a Study of Efficacy and Safety of Two Secukinumab Dose Regimens in Subjects With Moderate to Severe Hidradenitis Suppurativa (HS). (SUNSHINE). NCT03713619. Available at: https://clinicaltrials.gov/ct2/show/NCT03713619 [Last accessed: April 2023].
11. Girolomoni G, Mrowietz U, Paul C. Psoriasis: rationale for targeting interleukin-17. Br J Dermatol 2012; 167: 717–724.
12. Novartis Europharm Limited. Cosentyx® (secukinumab): Summary of Product Characteristics. Available at: https://www.ema.europa.eu/en/documents/product-information/cosentyx-epar-product-information_en.pdf [Last accessed: April 2023].
13. Baraliakos X, Braun J, Deodhar A, et al. Long-term efficacy and safety of secukinumab 150 mg in ankylosing spondylitis: 5-year results from the phase III MEASURE 1 extension study. RMD Open 2019; 5: e001005
14. Bissonnette R, Luger T, Thaçi D, et al. Secukinumab demonstrates high sustained efficacy and a favourable safety profile in patients with moderate-to-severe psoriasis through 5 years of treatment (SCULPTURE Extension Study). J Eur Acad Dermatol Venereol 2018; 32: 1507–1514.
15. Mease PJ, Kavanaugh A, Reimold A, et al. Secukinumab Provides Sustained Improvements in the Signs and Symptoms of Psoriatic Arthritis: Final 5-year Results from the Phase 3 FUTURE 1 Study. ACR Open Rheumatol 2020; 2: 18–25.
16. Data on file. CAIN457F2310 (MEASURE 1 and 2): Pooled Safety Data. Novartis Pharmaceuticals Corp; July 23, 2018.
17. Data on file. CAIN457F2310 and CAIN457F2305 summary of 5-year clinical safety in (ankylosing spondylitis). Novartis Pharmaceuticals Corp; May 2019.
18. Data on file. CAIN457F2312 (FUTURE 2): 5 year-interim report. Novartis Pharmaceuticals Corp; May 2019.
19. McInnes IB, Mease PJ, Kirkham B, et al. Secukinumab, a human anti-interleukin-17A monoclonal antibody, in patients with psoriatic arthritis (FUTURE 2): a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet 2015; 386: 1137–1146.
20. Data on file. COSENTYX Access. Novartis Pharmaceuticals Corp; January 2023.
21. Data on file. COSENTYX Approvals. Novartis Pharmaceuticals Corp; March 2023.
22. Novartis AG. 2021. Novartis Cosentyx® receives FDA approval for the treatment of children and adolescents with enthesitis-related arthritis and psoriatic arthritis. [Press release]. Available at: https://www.novartis.com/news/media-releases/novartis-cosentyx-receives-fda-approval-treatment-children-and-adolescents-enthesitis-related-arthritis-and-psoriatic-arthritis [Last accessed: April 2023].
23. Novartis AG. 2022. Novartis Cosentyx® (secukinumab) receives positive CHMP opinion for expanded use in childhood arthritic conditions. [Press release]. Available at: https://www.novartis.com/news/media-releases/novartis-cosentyx-secukinumab-receives-positive-chmp-opinion-expanded-use-childhood-arthritic-conditions [Last accessed: April 2023].




