1. Introducción
Las hormonas tiroideas son vitales para el buen funcionamiento del sistema reproductor femenino, ya que modulan el metabolismo y el desarrollo de los tejidos ovárico, uterino y placentario. Por lo tanto, el hipo e hipertiroidismo pueden provocar subfertilidad o infertilidad1.
La infertilidad se define como la incapacidad de concebir tras más de 1 año de relaciones no protegidas. Se estima que un 8-12% de parejas en edad reproductiva a nivel mundial presentan infertilidad2. La fertilidad disminuye de forma exponencial con el incremento de la edad debido a una reducción tanto en la cantidad como en la calidad de los ovocitos presentes en los ovarios y arrestados en meiosis desde el período fetal. La infertilidad puede deberse a un factor femenino (35%), masculino (20-30%), mixto (20%) o desconocido (15%)3. La disfunción tiroidea afecta tanto a la fertilidad femenina como a la masculina, si bien la evidencia en fertilidad masculina es limitada4.

Dra. Gemma Sesmilo
Fuente: Dra. Sesmilo
La disfunción tiroidea más común es la autoinmune y es a la que nos vamos a referir en este artículo. Dada la escasez de datos en varones, en este artículo nos centraremos en la fertilidad femenina y daremos sólo una pincelada sobre la fertilidad masculina.
2. Epidemiología
La prevalencia de enfermedad tiroidea autoinmune en mujeres de 20 a 45 años es elevada y está más incrementada en pacientes que se someten a Técnicas de Reproducción Asistida (TRA), aunque existen resultados discrepantes entre distintos estudios5. Se estima que, en población en edad fértil, entre un 5-7% tendrían hipotiroidismo subclínico, un 2-4,5% hipotiroidismo franco, un 0,5-1% hipertiroidismo y entre un 5 y un 10% Autoinmunidad Tiroidea (AIT)6. La prevalencia de AIT en población con infertilidad depende de las causas de infertilidad, habiéndose descrito una mayor prevalencia de AIT en pacientes con Síndrome de Ovario Poliquístico (SOP),4,5,7 endometriosis5 y en pacientes con fallo ovárico prematuro4,5,8, correlacionándose, incluso, el nivel de Hormona Estimulante de la Tiroides (TSH) con el de la Hormona Antimulleriana (AHM)9.
3. Impacto de la AIT en los resultados de las TRA y en marcadores de reserva ovárica
Un metaanálisis reciente ha revisado sistemáticamente los estudios publicados en este tema concluyendo que las pacientes con AIT presentan: menores tasas de implantación (OR= 0,72 sobre 7118 pacientes), mayores tasas de abortos (OR 1,52 sobre 7.606 pacientes) y menores tasas de recién nacidos vivos (OR 0,73 n=11417)10.
Esto no se observó en el subgrupo de pacientes en las que se realizó inyección intracitoplasmática de esperma (ICSI) versus Fecundación in vitro convencional (FIV)10.
No se encontraron diferencias en los parámetros de reserva ovárica: AMH, Hormona Foliculoestimulante (FSH) basal en fase folicular precoz, contaje de folículos antrales y número de ovocitos conseguidos tras estimulación ovárica entre pacientes con o sin AIT. No obstante, se hizo notar que la evidencia científica es de baja calidad10.
4. Fisiopatología
Los mecanismos fisiopatológicos implicados en la disfunción tiroidea en fertilidad son directos e indirectos. Las hormonas tiroideas participan en la regulación de la función ovárica por efecto directo en ovario y ovocito, donde existen receptores de TSH y de hormonas tiroideas4,11; asimismo, las células de la granulosa expresan receptores de TSH y T3 (triyodotironina) que inducen su proliferación.
Los efectos indirectos incluyen la repercusión de la función tiroidea en el eje hipotálamo-hipófiso-gonadal, a través de cambios en TRH (hormona liberadora de tirotropina) y adipocitokinas, que a su vez afectan a la GnRH (hormona liberadora de gonadotropinas) y PRL (prolactina) influyendo tanto en la foliculogénesis como en la respuesta del cuerpo lúteo a la hormona luteinizante (LH) y también por efectos de la función tiroidea sobre la Globulina Fijadora de Hormonas Sexuales (SHBG)4.
En cuanto a la autoinmunidad tiroidea (AIT) y su repercusión en fertilidad, hay tres hipótesis fisiopatológicas:
1. que la AIT sea un estado de autoinmunidad generalizada con un aumento de la citotoxicidad
2. que los anticuerpos antitiroideos tengan un efecto directo en ovario-ovocito (hipótesis del folículo ovárico) y
3. la AIT causaría un hipotiroidismo relativo con descenso de T3 e impacto en la fertilidad4,12.
Monteleone y cols. hallaron anticuerpos antiperoxidasa y antitiroglobulina en suero y en líquido folicular de mujeres con infertilidad generando la ‘hipótesis del folículo ovárico’, que implicaría una acción directa en ovocito12,13. Kelkar y cols hallaron autoanticuerpos contra la zona pelúcida en mujeres con fallo ovárico prematuro; estos autoanticuerpos presentaron inmuno-reactividad cruzada para el tiroides14. Se cree que este podría ser uno de los motivos por el que la ICSI -que no precisa integridad de la zona pelúcida- tendría mejor resultado que la FIV convencional en casos de autoinmunidad tiroidea10.
5. Tratamiento con levotiroxina (LT4) en mujeres con eutiroidismo y con hipotiroidismo subclínico sometidas a TRA
¿El tratamiento con levotiroxina (LT4) en mujeres con hipotiroidismo subclínico y AIT mejora los resultados de la TRA?
Esta cuestión se evaluó en un metaanálisis y revisión sistemática que incluyó 3 estudios aleatorizados15. Las pacientes que recibieron LT4 presentaron tasas de ovocitos fertilizados, de implantación y de recién nacidos vivos superiores a las pacientes que no recibieron LT4. Sin embargo, no se hallaron diferencias significativas en el número de ovocitos obtenidos tras estimulación, el número de ovocitos maduros y el número de embriones transferidos. Los estudios que mostraron mejores resultados fueron los dos que incluyeron pacientes con una TSH basal superior a 4 mUI/L15.
¿El tratamiento con levotiroxina (LT4) en mujeres eutiroideas con AIT mejora los resultados de la TRA?
Esta cuestión se evaluó en un ensayo clínico abierto en 600 pacientes eutiroideas con AIT en China, aleatorizadas a recibir tratamiento con LT4 durante el proceso de FIV versus no tratamiento. No se observaron diferencias en las tasas de embarazo, aborto y de recién nacidos vivos entre los dos grupos16.
Una revisión sistemática Cochrane que incluyó este y otros estudios más pequeños concluyó que no se podían sacar conclusiones debido a la calidad baja y muy baja de los estudios incluidos (3 estudios n= 820)17.
6. Ajuste de tratamiento en mujeres tratadas con levotiroxina sometidas a TRA
Las técnicas de reproducción asistida conllevan un tratamiento específico que varía en función del subtipo de TRA y de cuestiones individuales de cada paciente. Según el tipo de técnica se precisa o no tratamiento de estimulación de la ovulación18.
El tratamiento de inducción de ovulación implica el uso de agonistas o antagonistas de la GnRH, gonadotrofinas y progestágenos, que a su vez van a tener repercusión en los niveles de estrógenos y de Globulina Fijadora de Tiroxina (TBG), y que a su vez pueden repercutir también en las necesidades de levotiroxina19.
La administración de gonadotropina coriónica humana (hCG) en dosis altas a mitad de ciclo para estimular ovulación podría eventualmente inhibir transitoriamente TSH o elevarla más por el pico estrogénico que le sigue. Los niveles de estradiol alcanzados en los ciclos de estimulación pueden ser del orden de los habituales en gestación20.
La inseminación artificial suele ser la técnica que precisa menos intervención; la FIV convencional y la FIV con ICSI a su vez pueden acompañarse de transferencia de embriones en el mismo ciclo de estimulación ovárica (en fresco) o no. La criotransferencia es la transferencia de embriones congelados que pueden haberse obtenido en un ciclo de estimulación de ovulación de la paciente o de ovodonación o embriodonación. A su vez, una criotransferencia puede realizarse en ciclo natural -con soporte progestágeno- o en ciclo con soporte estro-progestágeno.
Gracia y cols. estudiaron 57 pacientes antes, durante y tras la estimulación de la ovulación; sólo 9 tenían hipotiroidismo tratado. De las pacientes con TSH ≤2,5 antes del procedimiento, un 44% elevaron TSH durante el procedimiento, más frecuente y con mayor pico de TSH en pacientes con hipotiroidismo tratado20.
En un estudio de Busneli y cols. la tasa de gestación fue similar en las pacientes con TSH > o < a 2,5 durante el procedimiento. Revisaron 72 pacientes con hipotiroidismo tratado durante el proceso fertilización in vitro. Un 64% presentaron TSH > 2,5 el día de administración del pico de hCG y un 68% a los 16 días21.
Estos estudios indican que la TSH aumenta en un ciclo de TRA y que, en vida real, un elevado % de pacientes tratadas con LT4 presenten TSH superior a 2,5 mUI/L durante el procedimiento.
Dos meta-análisis han reportado la elevación de TSH durante el ciclo de TRA, más marcada en pacientes con hipotiroidismo, apuntando a un pico en el momento de la prueba de embarazo22,23.
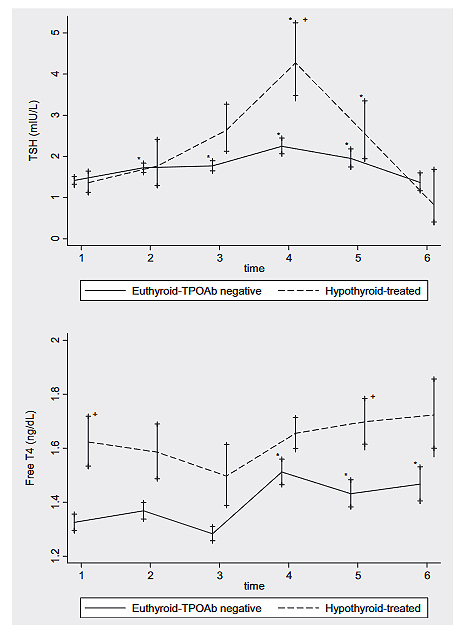
Figura 1. TSH y T4 libre (Free T4) según estatus tiroideo (eutiroideas TPOAb- n=45 o hipotiroideas tratadas n=9) a lo largo del proceso de estimulación de la ovulación. Tiempos: 1: antes de la estimulación, 2: 4-7 días tras inicio, 3: a la administración de hCG, 4: 1 semana tras hCG, 5: el día del test de embarazo, 6: dos semanas tras test de embarazo. *P < 0,01 en cada grupo respecto al tiempo 1. +P <0,01 para comparación entre grupos en cada tiempo
TPOAb: Anticuerpos antiperoxidasa tiroidea; TSH: Hormona estimulante de la tiroides; T4: Tiroxina; hCG: Gonadotropina coriónica humana
Extraída de la referencia 20
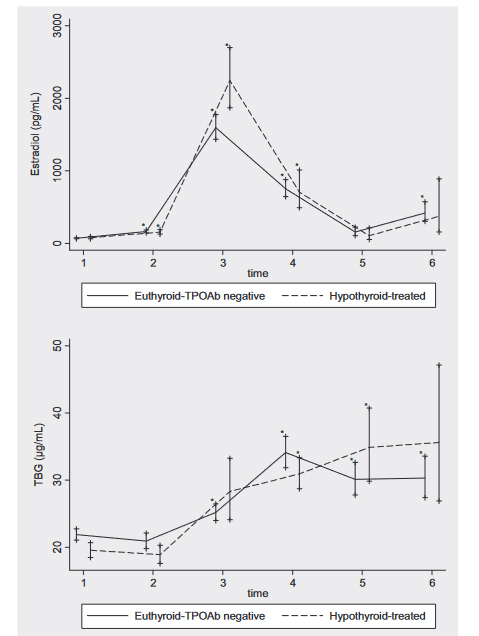
Figura 2. Estradiol y TBG según estatus tiroideo (eutiroideas TPOAb- n=45 o hipotiroideas tratadas n=9) a lo largo del proceso de estimulación de la ovulación. Tiempos: 1: antes de la estimulación, 2: 4-7 días tras inicio, 3: a la administración de hCG, 4: 1 semana tras hCG, 5: el día del test de embarazo, 6: dos semanas tras test de embarazo. *P < 0,01 en cada grupo respecto al tiempo 1. +P <0,01 para comparación entre grupos en cada tiempo.
TPOAb: Anticuerpos antiperoxidasa tiroidea; TBG: Globulina Fijadora de Tiroxina; hCG: Gonadotropina coriónica humana
Extraída de la referencia 20
En resumen, cada subtipo de TRA tendrá un impacto distinto sobre las necesidades de LT4 en función del tratamiento asociado y en función de la enfermedad tiroidea de la paciente.
No existen estudios prospectivos sobre la idoneidad del ajuste de dosis de levotiroxina en pacientes sometidas a TRA. Esto hace que debamos monitorizar de cerca a estas pacientes y conocer el tratamiento que están realizando idealmente en el marco de equipos especializados.
Guías clínicas6
La European Thyroid Association (ETA) publicó en 2021 guías específicas sobre el manejo de las alteraciones tiroideas en pacientes en proceso de TRA6.
Respecto al cribado: la ETA recomienda estudio sistemático de TSH y TPOAb (anticuerpos antiperoxidasa tiroidea) en mujeres subfértiles (TGAb -anticuerpos antitiroglobulina- depende de reglas locales o de si TPOAb negativo o de si TSH >2,5).
Recomiendan tratar a aquellas pacientes con o sin autoinmunidad tiroidea con TSH >4 (o superior al umbral normal -ULN-) que están en un proceso de TRA6.
Para pacientes con TSH entre 2,5 y 4 recomiendan individualizar en casos de baja reserva ovárica o fallo ovárico prematuro, edad > 35 años, abortos de repetición o títulos de anticuerpos antitiroideos muy elevados. Sugiere tratar a mujeres con AIT y TSH entre 2,5 y 4 con dosis bajas de LT4 (entre 25 y 50 mcg/día) y tratar aquellas con TSH >4 o por encima del límite alto de normalidad para mantener una TSH <2,5 mIU/L. No recomiendan tratar a mujeres eutiroideas sin AIT6.
La guía ETA recomienda medir TSH tras la estimulación ovárica y el día del segundo test confirmatorio de gestación en mujeres con AIT. No recomiendan monitorizar TSH en pacientes eutiroideas sin AIT, excepto si reciben tratamiento con LT4. En mujeres tratadas con LT4 recomiendan ajustar la dosis de LT4 antes de la estimulación ovárica para mantener TSH <2,56.
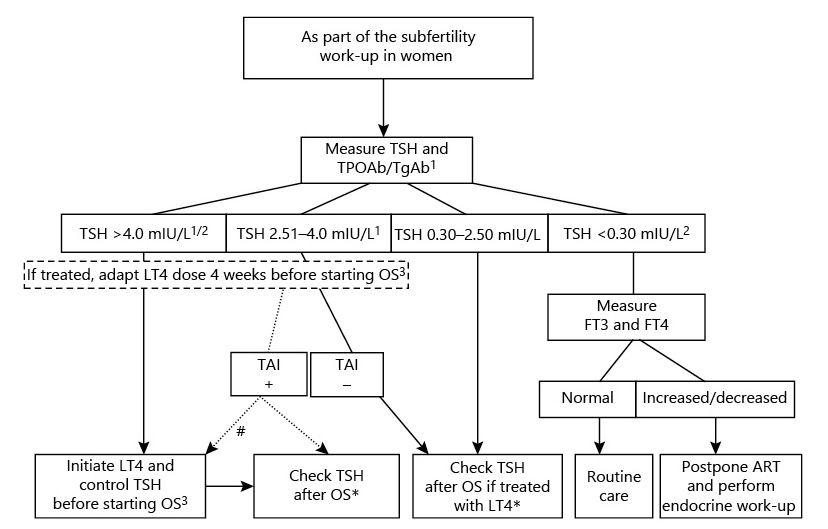
Figura 3. Algoritmo de manejo de los desórdenes tiroideos en mujeres subfértiles que inician un proceso de TRA. 1 si no es posible por razones locales, medir TgAb en caso de TSH >2,5 y TPOAb negativo/ o buscar características ecográficas de AIT (si disponibilidad). 2 o bien por encima o debajo del rango normal del ensayo. 3 dosis de LT4 depende del nivel de TSH y peso corporal: empezar 25 mcg si TSH 2,5-4 mUI/L—> target < 2,5 mUI/L. #Decidir tratamiento en cada caso. *En caso de embarazo, el día de la segunda/confirmatoria medición de hCG
TPOAb: Anticuerpos antiperoxidasa tiroidea; TGAb: Anticuerpos antitiroglobulina; TSH: Hormona estimulante de la tiroides; LT4: Levotiroxina; OS: Estimulación ovárica; FT3: Triyodotironina libre; FT4: Levotiroxina libre; TAI: Autoinmunidad Tiroidea (AIT); ART: Técnicas de Reproducción Asistida (TRA); TRA: Técnicas de Reproducción Asistida; AIT: Autoinmunidad Tiroidea; hCG: Gonadotropina coriónica humana
Extraída de la referencia 6
Las hormonas tiroideas afectan la fertilidad masculina por efecto sobre las células de Sertoli, las de Leydig y sobre el eje hipotálamo-hipófiso-gonadal4.
La disfunción tiroidea franca se ha asociado con alteraciones en el seminograma y función eréctil6.
La guía ETA revisa este tema y recomienda determinar TSH sólo cuando existen problemas de eyaculación, disfunción eréctil o bien seminograma alterado6. También recomiendan no postponer el tratamiento de TRA en caso de disfunción tiroidea franca si los parámetros del seminograma no están severamente afectados6.
CONCLUSIONES
• La función tiroidea juega un papel fundamental en la fertilidad masculina y femenina.
• La presencia de autoinmunidad tiroidea podría tener un efecto directo sobre el ovocito, podría suponer citotoxicidad generalizada o un estado de insuficiencia tiroidea relativa que se asociaría a infertilidad.
• La hiperestimulación de la ovulación en los tratamientos de reproducción asistida y el tratamiento hormonal asociado implican una elevación suprafisiológica de los niveles de estrógenos y la necesidad de ajuste de dosis y monitorización de las pacientes con AIT y/o tratamiento con LT4.
• Las últimas guías clínicas ETA aconsejan el cribado universal de TSH y TPOAb a todas las pacientes sometidas a TRA y aconsejan tratar a las pacientes en TRA y AIT con TSH > 2,5.
• No se aconseja cribado de TSH en varones con infertilidad salvo si hay anomalías en el seminograma.
2304SO000030
Bibliografía
1. Silva JF, Ocarino NM, Serakides R. Thyroid hormones and female reproduction†. Biology of Reproduction. 2018; 99(5), 907–921
2. Inhorn MC, Patrizio P, Infertility around the globe: new thinking on gender, reproductive technologies and global movements in the 21st century. Hum Reprod Update. 2014:21:411–426.
3. Łakoma K, Kukharuk O, Śliż D. The Influence of Metabolic Factors and Diet on Fertility. Nutrients 2023 Feb 27;15(5):1180.
4. Mazzilli R, Medenica S, Di Tommaso AM, Fabozzi G, Zamponi V, Cimadomo D et al.. The role of thyroid function in female and male infertility: a narrative review. J Endocrinol Invest 2023;46(1):15-26.
5. Bucci I-, Giuliani C, Di Dalmazi G, Formoso G, Napolitano G. Thyroid Autoimmunity in Female Infertility and Assisted Reproductive Technology Outcome. Front Endocrinol (Lausanne). 2022;13:768363.
6. Poppe K, Bisschop P, Fugazzola L, Minziori G, Unuane D, Weghofer A.European Thyroid Association Guideline on Thyroid Disorders prior to and during Assisted Reproduction. Eur Thyroid J. 2021;9(6):281-295.
7. Grossmann B, Saur S, Rall K, Pecher AC, Hübner S, Henes J, et al. Prevalence of auto- immune disease in women with premature ovarian failure. Eur J Contracept Reprod Health Care. 2020 ;25(1):72–5.
8. Romitti M, Fabris VC, Ziegelmann PK, Maia AL, Spritzer PM. Association between PCOS and autoimmune thyroid disease: a system- atic review and meta-analysis. Endocr Con- nect. 2018;7(11):1158–67.
9. Weghofer A, Barad DH, Darmon S, Kushnir VA, Gleicher N. What affects functional ovarian reserve, thyroid function or thyroid auto- immunity? Reprod Biol Endocrinol. 2016;14(1):26.
10. Busnelli A, Beltratti C, Cirillo F, Bulfoni A, Lania A, Levi-Setti PE. Impact of Thyroid Autoimmunity on Assisted Reproductive Technology Outcomes and Ovarian Reserve Markers: An Updated Systematic Review and Meta-Analysis. Thyroid. 2022;32(9):1010-1028.
11. Aghajanova L, Lindeberg M, Carlsson IB et al. Receptors for thyroid-stimulating hormone and thyroid hormones in human ovarian tissue. Reprod Biomed Online.2009 18:337–347
12. Monteleone P, Parrini D, Faviana P, Carletti E, Casarosa E, Uccelli A et al. Female infertility related to thyroid autoimmunity: the ovarian follicle hypothesis. Am J Reprod Immunol. 2011 ;66(2):108-14.
13. Colicchia M, Campagnolo L, Baldini E, Ulisse S, Valensise H, Moretti C. Molecular basis of thyrotropin and thyroid hormone action during implantation and early development. Hum Reprod Update. 2014;20(6): 884–904.
14. Kelkar RL, Meherji PK, Kadam SS, Gupta SK, Nandedkar TD. Circulating auto-antibodies against the zona pellucida and thyroid microsomal antigen in women with premature ovarian failure. J Reprod Immunol 2005;66(1):53-67
15. Velkeniers B, Van Meerhaeghe A, Poppe K, Unuane D, Tournaye H, Haentjens P. Levo- thyroxine treatment and pregnancy outcome in women with subclinical hypothyroidism undergoing assisted reproduction technolo- gies: systematic review and meta-analysis of RCTs. Hum Reprod Update. 2013; 19(3):251–8.
16. Wang H, Gao H, Chi H, Zeng L, Xiao W, Wang Y et al. Effect of Levothyroxine on Miscarriage Among Women With Normal Thyroid Function and Thyroid Autoimmunity Undergoing In Vitro Fertilization and Embryo Transfer: A Randomized Clinical Trial. JAMA. 2017;12;318(22):2190-2198.
17. Akhtar MA, Agrawal R, Brown J, Sajjad Y, Craciunas L. Thyroxine replacement for subfertile women with euthyroid autoimmune thyroid disease or subclinical hypothyroidism. Cochrane Database Syst Rev. 2019; 25;6(6)
18. Estimulación ovárica para FIV-ICSI en los ciclos con presunción de normorrespuesta. Sociedad Española de Ginecología y Obstetricia. Prog Obstet Ginecol 2019;62(06):587-593
19. Prodromidou A, Anagnostou E, Mavrogianni D, Liokari E, Dimitroulia E, Drakakis P, Loutradis D. Past, Present, and Future of Gonadotropin Use in Controlled Ovarian Stimulation During Assisted Reproductive Techniques. Cureus. 2021:15;13(6)
20. Gracia CR, Morse CB, Chan G, Schilling S, Prewitt M, Sammel MD et al. Thyroid function during controlled ovarian hyperstimulation as part of in vitro fertilization. Fertil Steril 2012;97:585–91.
21. Busnelli A, Somigliana E, Benaglia L, Sarais V, Ragni G, Fedele L. Thyroid axis dysregulation during in vitro fertilization in hypothyroid-treated patients. Thyroid 2014;24:1650–5.
22. Li D, Hu S, Meng X, Yu X. Changes in thyroid function during controlled ovarian hyperstimulation (COH) and its impact on assisted reproduction technology (ART) outcomes: a systematic review and meta-analysis. J Assist Reprod Genet. 2021;38(9):2227-2235.
23. Busnelli A, Cirillo F, Levi-Setti PE. Thyroid function modifications in women undergoing controlled ovarian hyperstimulation for in vitro fertilization: a systematic review and meta-analysis. Fertil Steril. 2021;116(1):218-231.




