El SARS-CoV-2 es un nuevo coronavirus que se propaga rápidamente a una velocidad nunca vista hasta ahora, cursando como una infección grave (COVID-19). Las estrategias actuales de tratamiento del SARS-CoV-2/COVID-19 van desde las medidas preventivas (sociales), hasta la vacunación pasando por los cuidados de apoyo. Se han identificado varios factores de riesgo para la infección o el curso de la enfermedad, como la edad, el sexo, la obesidad, la hipertensión, la diabetes y el compromiso del sistema inmunitario1.
Desde el comienzo de la pandemia se ha propuesto como posible factor preventivo de la infección por el SARS-CoV-2, la progresión de la enfermedad y la mortalidad, una función adecuada del sistema endocrino de la vitamina D (VDES). Cada vez hay más pruebas de una desregulación del VDES en las células pulmonares e inmunitarias de los pacientes infectados por el SARS-CoV-22,3.

Dr. José Manuel Quesada Gómez
Fuente: Dr. Quesada Gómez
El colecalciferol o vitamina D3, el nutriente umbral del VDES, es el precursor de la 25-hidroxivitamina D3 o calcifediol [25OHD], una prohormona comúnmente utilizada para medir el estado nutricional del VDES. La 25OHD es el sustrato para la síntesis de la 1,25-dihidroxivitamina D [1,25(OH)2D], el metabolito hormonalmente activo que se une con gran afinidad a su receptor (VDR), un miembro de los factores de transcripción nuclear. El VDR estimulado regula un gran número de genes, sobre todo en grupos coherentes. La principal acción del VDES/VDR se centra en el intestino, donde estimula la absorción activa de calcio y, por tanto, permite el desarrollo normal de los huesos y reduce el riesgo de osteoporosis. La mayoría de las células nucleadas expresan el VDR y muchas de ellas también expresan el CYP27B1, la enzima responsable de la conversión de la 25OHD en 1,25(OH)2D y, por tanto, son capaces de producir esta hormona de forma auto/para/endocrina. Por último, la mayoría de las células responden a la activación del VDR mediante cambios en la expresión de genes o proteínas o en la diferenciación y función celular, con múltiples acciones extraóseas4.
Desde una perspectiva mecanicista, hay buenas razones para postular que VDES puede tener efectos beneficiosos en las diferentes etapas de las infecciones por COVID-19. Se sabe que el pulmón, el endotelio y las células inmunitarias son tejidos diana del sistema endocrino de la vitamina D (VDES). También existen varios mecanismos plausibles que vinculan un VDES deficiente y el riesgo y, sobre todo, la gravedad de la infección por SARS-CoV-2. El VDES puede interferir en la infección viral temprana (mediante mecanismos efectores antivirales de la inmunidad innata, incluida la inducción de interferones, péptidos antimicrobianos como la catelicidina/defensinas y la autofagia). El VDES también está implicado en la reducción de la fase hiperinflamatoria de la COVID-19, que da lugar al síndrome de dificultad respiratoria aguda, mediante la disminución de la tormenta de citoquinas/quimioquinas, un cambio hacia respuestas inmunitarias adaptativas Th2, la regulación del sistema renina-angiotensina-bradiquinina, la modulación de la actividad de los neutrófilos, el mantenimiento de la integridad de la barrera epitelial pulmonar y la disminución de la coagulabilidad2,3.
A lo largo de la pandemia, se han publicado numerosos estudios epidemiológicos y de asociación que investigan los vínculos entre los niveles circulantes de 25OHD y la incidencia y la gravedad de la COVID-19. Inicialmente, se trataba de estudios ecológicos de observación que describían una mayor incidencia de infección y muerte por COVID-19 en países donde la deficiencia de vitamina D (o la baja exposición al sol) era común. Posteriormente, varios estudios evaluaron la asociación entre el estado de la vitamina D y el riesgo o la gravedad de la infección por SARS-CoV-23.
Múltiples metaanálisis recientes han analizado los datos disponibles que relacionan los niveles séricos de 25OHD con el riesgo o la gravedad (ingreso en la Unidad de Cuidados Intensivos (UCI) y mortalidad) de la COVID-193. En diciembre de 2021 se publicó el mayor metaanálisis realizado hasta la fecha, que incluía 54 estudios clínicos, con un total de 1.403.715 pacientes, en los que se investigaba la relación entre el estado de la 25OHD y la infección por COVID-19 y sus resultados5. Este análisis proporciona pruebas consistentes de que los niveles bajos de 25OHD se asocian con un mayor riesgo de infección por SARS-CoV-2, gravedad (hospitalización e ingreso en la UCI) y mortalidad por COVID-19, independientemente del punto de corte elegido en la evaluación (deficiencia grave (<10 ng/ml), deficiencia (<20 ng/ml) e insuficiencia (<30 ng/ml))5. Los conjuntos de datos descritos proporcionan pruebas sólidas de que un nivel bajo de 25OHD es un factor predictivo del resultado clínico, y no sólo un efecto secundario de la infección. Chiodini, et al sugieren que se necesitan niveles séricos de 25OHD por encima de 30 ng/ml para minimizar la carga clínica de la infección por coronavirus SARS-CoV-26.
Estos resultados sugieren que un bajo nivel de 25OHD constituye un factor de riesgo adicional y que la mejora de los niveles séricos de 25OHD podría mejorar el resultado de las infecciones por COVID-19.
Tratamiento con calcifediol para COVID-19
De entre los metabolitos del VDES, el calcifediol tiene una mayor tasa de absorción intestinal, especialmente en casos de mala absorción. Es más hidrófilo que el colecalciferol y evita el paso hepático, por lo que recupera los valores normales de 25OHD de forma más rápida y predecible que el colecalciferol, proporcionando casi inmediatamente después de la administración oral el sustrato adecuado para la síntesis de 1,25(OH)2D7.
Para investigar el posible beneficio terapéutico del calcifediol, se han diseñado dos estrategias de intervención. Una de ellas utiliza dosis elevadas de calcifediol8-10, y la otra, dosis mucho más bajas11.
Asistencia hospitalaria a un paciente durante la crisis del coronavirus
Fuente: Francisco Avia / Hospital Clínic de Barcelona (IMAGEN DE ARCHIVO)
El primer estudio publicado, en el que se utilizó un enfoque de dosis altas, fue un ensayo clínico piloto paralelo, abierto, aleatorizado y con doble enmascaramiento, realizado en el Hospital Universitario Reina Sofía de Córdoba (preliminar al ensayo clínico registrado como "Prevención y tratamiento con calcifediol del síndrome respiratorio agudo inducido por el virus de la Corona (SARS) COVID-19 (COVIDIOL)" [NCT0436690])8. Así, en 76 pacientes consecutivos hospitalizados con COVID-19, los cuadros clínicos de infección respiratoria aguda se confirmaron por el patrón radiográfico de neumonía viral y por la PCR positiva para el SARS-CoV-2 con la escala de gravedad CURB65 (recomendando el ingreso hospitalario en caso de puntuación total >1). Todos los pacientes hospitalizados recibieron como mejor tratamiento disponible el mismo estándar de atención, (según el protocolo del hospital), una combinación de hidroxicloroquina (400 mg cada 12 h el primer día y 200 mg cada 12 h durante los siguientes 5 días), y azitromicina (500 mg por vía oral durante 5 días).
Los pacientes elegibles fueron asignados a calcifediol oral/no calcifediol en una proporción de 2:1, mediante aleatorización electrónica. La pauta de tratamiento, diseñada en función de la cinética del calcifediol en la formulación utilizada, consistió en calcifediol oral (0,532 mg el día del ingreso), seguido de dosis de 0,266 mg los días 3 y 7, y luego semanalmente hasta el alta o el ingreso en UCI. Los resultados de eficacia fueron convincentes: de 50 pacientes tratados con calcifediol, sólo uno requirió ingreso en la UCI (2%), mientras que, de 26 pacientes no tratados, 13 requirieron ingreso (50%) (p = 0,00000077). Odds ratio estimada del riesgo univariante de UCI en los pacientes tratados con calcifediol frente a los no tratados con calcifediol: 0,02 (95% CI 0,002-0,17). Odds ratio de la estimación del riesgo multivariante para UCI en pacientes con tratamiento con calcifediol frente a UCI sin tratamiento con calcifediol (ajustando por hipertensión y diabetes tipo 2): 0,03 (95% CI: 0,003-0,25). De los pacientes tratados con calcifediol ninguno murió, y todos fueron dados de alta sin complicaciones. El número de muertes fue demasiado pequeño para alcanzar la significación estadística frente a una hipótesis nula de ausencia de efecto, pero el resultado es coherente con la hipótesis plausible de que la disminución de la mortalidad sería similar a la disminución de los ingresos en la UCI.
Inmediatamente después, un estudio retrospectivo de pacientes hospitalizados por infección por COVID-19 confirmada por PCR (excluyendo a los pacientes implicados en el estudio piloto recién mencionado) aborda la reducción de la mortalidad en los pacientes tratados con calcifediol. Los pacientes de cinco hospitales de Andalucía (n = 537) hospitalizados por COVID-19 recibieron atención estándar para las comorbilidades preexistentes y calcifediol o no, según el esquema de tratamiento del estudio piloto citado. Los pacientes de un hospital volvieron a tener la opción de recibir calcifediol, mientras que esta opción no estaba disponible en los demás hospitales. Un número ligeramente mayor de pacientes en el grupo tratado con calcifediol tenía una o más comorbilidades al inicio del estudio. La mortalidad intrahospitalaria durante los primeros 30 días fue del 17,5%. La OR de muerte para los pacientes que recibieron calcifediol (tasa de mortalidad del 5%) fue de 0,22 (IC del 95%: 0,08-0,61), en comparación con los pacientes que no recibieron calcifediol (tasa de mortalidad del 20%; p = 0,0005). En el modelo de regresión logística multivariable, hubo una diferencia significativa en la mortalidad de los pacientes que recibieron calcifediol, en comparación con los que no lo recibieron (OR = 0,16; IC del 95%: 0,03-0,80)9.
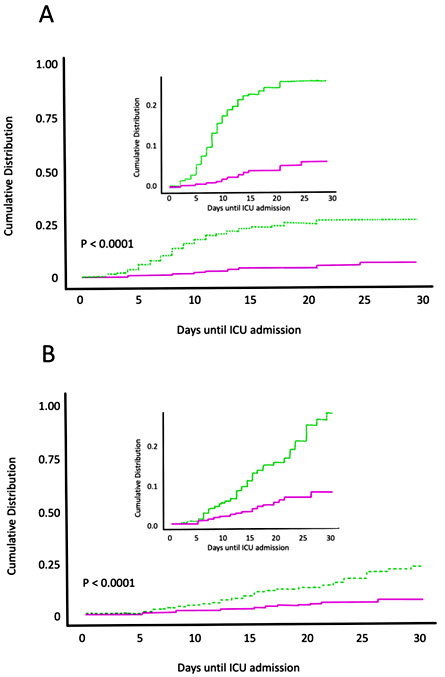
Figura 1. Administración temprana de calcifediol a dosis altas y resultado en COVID-19. Pacientes hospitalizados con COVID-19 en tratamiento con calcifediol, (fucsia) vs. los que no recibieron calcifediol (verde), mostraron
A) una menor necesidad de ingreso en la UCI (45% frente a 21%) riesgo reducido (OR 0,13, IC 95% 0,07-0,23)
y B) una mortalidad intrahospitalaria significativamente menor durante los primeros 30 días (7% frente a 15,9%,) OR 0,21 [IC 95% 0,10, 57 0,43 p < 0,0001).
Producción propia a partir de Nogues X et al., referencia 10
A continuación, un estudio de cohortes observacional más amplio incluyó a pacientes ingresados en las salas COVID-19 del Hospital del Mar; Barcelona. El tratamiento con calcifediol redujo significativamente la necesidad de apoyo en la UCI y la mortalidad. De 838 pacientes, 447 recibieron calcifediol, mientras que 391 no fueron tratados en admisión. La prescripción de calcifediol se basó en la sala a la que estaban adscritos, en función de la disponibilidad de camas. En cinco de las ocho salas los pacientes recibieron calcifediol, mientras que en las otras tres no lo recibieron. Por lo demás, el tratamiento fue similar y no hubo diferencias significativas en las características de los pacientes. Entre los tratados al ingreso con calcifediol, el 4,5% requirió ingreso en la UCI, frente al 21% del grupo no tratado. La regresión logística del tratamiento con calcifediol al ingreso en la UCI, ajustada por edad, sexo, niveles basales de 25OHD lineales y comorbilidades, mostró que los pacientes tratados tenían un menor riesgo de requerir ingreso en la UCI (OR 0,13; IC del 95%: 0,07-0,23). Además, solo el 7% de los 55 tratados con calcifediol murieron al ingreso en comparación con el 15,9% de los no tratados. Los resultados ajustados mostraron una reducción del riesgo de mortalidad con una OR de 0,21 [IC del 95%: 0,10, 57 0,43])10 (Figura 1).
Se acaban de publicar los primeros resultados de la estrategia de administración diaria de dosis bajas de calcifediol: un ensayo clínico multicéntrico, aleatorizado, doble ciego y controlado con placebo realizado por la Universidad de Ciencias Médicas de Teherán y la Universidad de Ciencias Médicas Shahid Beheshti (Irán)11. El ensayo incluyó a pacientes, ingresados en el hospital de referencia para COVID-19, con niveles séricos de 25OHD inferiores a 30 ng/ml. Todos los pacientes recibieron el mismo tratamiento estándar (una combinación de hidroxicloroquina, azitromicina y, en los pacientes con neumonía, ceftriaxona). Los sujetos del grupo de tratamiento (n = 53) recibieron calcifediol, 25 μg administrados por vía oral una vez al día, y el grupo sin tratamiento (n = 53) recibió placebo. Al mes de tratamiento, los niveles séricos de 25OHD aumentaron significativamente en los pacientes que recibieron calcifediol (42,0 ±2,3 ng/ml) en comparación con el grupo de placebo, 19,3 ±1,7 ng/ml. Después de 60 días, 24 pacientes del grupo de tratamiento tenían niveles de 59,6 ±3,8 ng/ml frente a 19 pacientes del grupo de placebo 19,4 ±1,6 ng/ml (p <0,001). El tratamiento con calcifediol oral se asoció a un aumento significativo del porcentaje de linfocitos y a una disminución del cociente neutrófilos-linfocitos en los pacientes tratados con calcifediol, con una tendencia general a la disminución de la hospitalización, la duración de la estancia en la unidad de cuidados intensivos, la necesidad de asistencia respiratoria y la mortalidad, pero las diferencias no fueron estadísticamente significativas.
La ventaja de utilizar calcifediol es que las concentraciones séricas de 25OHD aumentan en cuestión de pocas horas. La gran y principal diferencia, del estudio iraní, con los tres estudios anteriores fue que la dosis de calcifediol de la primera semana en los tres primeros ensayos fue de 1,064 mg (0,532 en los dos primeros días), con una alta disponibilidad de 25OHD para su actuación en los órganos diana, en las primeras horas, en comparación con los 0,175 mg del estudio iraní.
Los datos disponibles sugieren firmemente que el tratamiento con calcifediol, a las dosis elevadas, puede disminuir la gravedad de la COVID-19, como lo demuestra la menor necesidad de cuidados intensivos y la disminución del riesgo de mortalidad. Se trata de un tratamiento rentable, sin efectos adversos importantes y ampliamente disponible, que podría tener implicaciones positivas para el tratamiento de la enfermedad en todo el mundo. Sin embargo, necesitamos los resultados de los grandes ensayos aleatorios en curso para completar las pruebas. Mientras tanto, basándonos en los datos disponibles, recomendamos la corrección rápida del déficit de 25OHD en todos los pacientes COVID+.
Referencias
1. Boban, M. Novel coronavirus disease (COVID-19) update on epidemiology, pathogenicity, clinical course and treatments. Int. J. Clin. Pract. 2021, 75, e13868, doi:10.1111/ijcp.13868.
2. Quesada-Gomez JM, Entrenas-Castillo M, Bouillon R Vitamin D receptor stimulation to reduce acute respiratory distress syndrome (ARDS) in patients with coronavirus SARS-CoV-2 infections: Revised Ms SBMB 2020_166.J Steroid Biochem Mol Biol. 2020 Sep;202:105719. doi: 10.1016/j.jsbmb.2020.105719.
3. Bouillon, R.; Quesada-Gomez, J.M. Vitamin D Endocrine System and COVID-19. JBMR Plus 2021, 5, e10576, doi:10.1002/jbm4.10576.
4. Bouillon R, Marcocci C, Carmeliet G, Bikle D, White JH, Dawson-Hughes B, Lips P, Munns CF, Lazaretti-Castro M, Giustina A, Bilezikian J.Skeletal and Extraskeletal Actions of Vitamin D: Current Evidence and Outstanding Questions.Endocr Rev. 2019 Aug 1;40(4):1109-1151. doi: 10.1210/er.2018-00126.
5. Borsche, L.; Glauner, B.; Mendel, J. von COVID-19 mortality risk correlates inversely with vitamin D3 status, and a mortality rate close to zero could theoretically be achieved at 50 ng/mL 25(OH)D3: Results of a systematic review and meta-analysis. Nutrients 2021, 13, 3596, doi:10.3390/nu13103596.
6. Chiodini, I.; Gatti, D.; Soranna, D.; Merlotti, D.; Mingiano, C.; Fassio, A.; Adami, G.; Falchetti, A.; Eller-Vainicher, C.; Rossini, M.; et al. Vitamin D Status and SARS-CoV-2 Infection and COVID-19 Clinical Outcomes. Front. Public Heal. 2021, 9, 736665, doi:10.3389/fpubh.2021.736665.
7. Quesada-Gomez JM, Bouillon R. Is calcifediol better than cholecalciferol for vitamin D supplementation?. Osteoporos Int. 2018 Aug;29(8):1697-1711. doi: 10.1007/s00198-018-4520-y.
8. Entrenas Castillo M, Entrenas Costa LM, Vaquero Barrios JM, Alcalá Díaz JF, López Miranda J, Bouillon R, Quesada Gomez JM. Effect of calcifediol treatment and best available therapy versus best available therapy on intensive care unit admission and mortality among patients hospitalized for COVID-19: A pilot randomized clinical study.J Steroid Biochem Mol Biol. 2020 Oct;203:105751. doi: 10.1016/j.jsbmb.2020.105751.
9. Alcala-Diaz JF, Limia-Perez L, Gomez-Huelgas R, Martin-Escalante MD, Cortes-Rodriguez B, Zambrana-Garcia JL, Entrenas-Castillo M, Perez-Caballero AI, López-Carmona MD, Garcia-Alegria J, Lozano Rodríguez-Mancheño A, Arenas-de Larriva MDS, Pérez-Belmonte LM, Jungreis I, Bouillon R, Quesada-Gomez JM, Lopez-Miranda J.Calcifediol Treatment and Hospital Mortality Due to COVID-19: A Cohort Study. Nutrients. 2021 May 21;13(6):1760. doi: 10.3390/nu13061760.
10. Nogues X, Ovejero D, Pineda-Moncusí M, Bouillon R, Arenas D, Pascual J, Ribes A, Guerri-Fernandez R, Villar-Garcia J, Rial A, Gimenez-Argente C, Cos ML, Rodriguez-Morera J, Campodarve I, Quesada-Gomez JM, Garcia-Giralt N.Calcifediol treatment and COVID-19-related outcomes. J Clin Endocrinol Metab. 2021 Jun 7:dgab405. doi: 10.1210/clinem/dgab405.
11. Maghbooli Z, Sahraian MA, Jamalimoghadamsiahkali S, Asadi A, Zarei A, Zendehdel A, Varzandi T, Mohammadnabi S, Alijani N, Karimi M, Shirvani A, Holick MF.Treatment With 25-Hydroxyvitamin D3 (Calcifediol) Is Associated With a Reduction in the Blood Neutrophil-to-Lymphocyte Ratio Marker of Disease Severity in Hospitalized Patients With COVID-19: A Pilot Multicenter, Randomized, Placebo-Controlled, Double-Blinded Clinical Trial. Endocr Pract. 2021 Dec;27(12):1242-1251. doi: 10.1016/j.eprac.2021.09.016.




