Drs. José María Huguet Malaves y Víctor Manuel García Lorenzo
INTRODUCCIÓN
El infliximab (IFX) fue el primer fármaco biológico aprobado para el tratamiento de la Enfermedad Inflamatoria Intestinal (EII). Desde 1998 disponemos de esta molécula anti-TNF en su formulación intravenosa (IV) y conocemos su eficacia tanto a corto como a largo plazo en el tratamiento de la EII1-3. Sin embargo, los fármacos biológicos son productos de alto coste, lo que debido al número cada vez mayor de pacientes tratados, ha supuesto una considerable carga financiera para los sistemas sanitarios públicos4,5.
Hoy en día, disponemos de los fármacos biosimilares, moléculas que guardan una gran similitud con los originales, tanto en estructura como en eficacia clínica. En 2013 la EMA aprobó el primer biosimilar de IFX, CT-P13 (comercializado bajo la marca Remsima®) tras demostrar su eficacia y seguridad en pacientes con enfermedades reumatológicas, extrapolándose los resultados para su empleo en EII. Posteriormente se publicó el ensayo NOR-SWITCH, el cual mostró que el cambio del original de IFX al CT-P13 no fue inferior al tratamiento continuado con el original de IFX6.

(de izq. a dcha): Drs. José María Huguet Malaves y Víctor Manuel García Lorenzo
Fuente: Drs. Huguet y García Lorenzo
Desde marzo de 2021, disponemos en nuestro país de Remsima® en su formulación subcutánea (SC). Ese mismo mes se publicó en formato online un ensayo clínico en el que se evaluó la no inferioridad de la formulación subcutánea frente a la intravenosa7. Se trataba de un ensayo clínico abierto y aleatorizado que incluía a 131 pacientes con EII activa. Estos pacientes recibieron durante la fase de inducción la formulación IV de CT-P13 a dosis de 5 mg/kg en las semanas 0 y 2. Posteriormente, en semana 6 los pacientes fueron aleatorizados (1:1) a CT-P13 SC o CT-P13 IV. Durante la fase de mantenimiento (semana 6-semana 54), los pacientes del grupo subcutáneo recibieron CT-P13 SC a dosis de 120 mg (pacientes <80 Kg) o 240 mg (pacientes >80 Kg) cada 2 semanas. Los pacientes del grupo intravenoso recibieron CT-P13 IV a dosis de 5 mg/kg cada 8 semanas desde la semana 6 hasta la semana 22. Desde la semana 30, los pacientes del grupo CT-P13 IV cambiaron para recibir CT-P13 SC cada 2 semanas hasta el final del estudio, en la semana 54.
Este estudio demostró la no inferioridad de la formulación subcutánea respecto a la administración del fármaco intravenoso en términos de farmacocinética. Las tasas de remisión clínica fueron similares en ambos grupos en la semana 30 (66,7% en el grupo SC y 54,7% en el IV; p=0,1620), así como la curación mucosa en la semana 22 (48,1% en SC y 41% en IV) definida por los criterios habituales (Mayo de 0 o 1 y SES-CD≤2). Los resultados de seguridad e inmunogenicidad no difirieron entre ambos grupos. Los niveles mínimos de infliximab alcanzados con la formulación SC se mantuvieron consistentemente por encima de la concentración terapéutica objetivo durante todo el estudio, siendo incluso mayores en la semana 22 en el grupo SC respecto al IV (20,9 μg/ml vs 1,8 μg/ml). Finalmente, tras el cambio a la formulación SC en el grupo IV, se alcanzaron niveles séricos similares en la semana 54 respecto al grupo de IFX SC.
DATOS EN PRÁCTICA CLÍNICA
En la actualidad, ya disponemos de algunos datos en práctica clínica sobre la utilización de Remsima® subcutáneo en los pacientes con EII.
La primera comunicación en este sentido fue de una serie inglesa que incluía a 172 pacientes con EII en tratamiento de mantenimiento con IFX IV a dosis de 5 mg/kg cada 8 semanas y a los que se les realizó el switch a IFX SC8,9. Se compararon los datos a los 6 meses del cambio a la formulación SC. Los resultados obtenidos no mostraron cambios significativos en los índices clínicos de actividad ni en los biomarcadores de inflamación (proteína C reactiva [PCR] y calprotectina fecal [CF]) tras el cambio a IFX SC, objetivándose un incremento significativo de los niveles séricos del fármaco tras la administración subcutánea a los 3 meses de seguimiento (basal = 9.8ug/mL vs. 3 meses = 14.6ug/mL; p<0.0001) que luego se mantenían estables a los 6 meses de seguimiento. Además, IFX SC presentó bajas tasas de eventos adversos, siendo bien tolerado por los pacientes.
Recientemente se ha publicado una serie española de pacientes con EII a los que se les decidió modificar el tratamiento de IFX IV a IFX SC10. Se trata de un estudio unicéntrico retrospectivo que incluía a 17 pacientes con EII, comparándose los datos a las 12 y 24 semanas de realizar el cambio. Los resultados obtenidos no mostraron cambios significativos tanto en los índices clínicos de actividad como en los biomarcadores séricos (PCR y velocidad de sedimentación globular), objetivándose un descenso significativo en los niveles de CF en la semana 24 (basal = 258,35 µg/g vs. semana 24 = 59,5 µg/g; p<0,05). Asimismo, los niveles séricos del fármaco aumentaron de forma significativa tras la administración de la formulación subcutánea (basal = 6,06 ug/mL vs. semana 24 = 19,9 ug/mL; p<0,001) sin registrar efectos adversos graves tras realizar el switch.
NUESTRA EXPERIENCIA CON EL CAMBIO DE INFLIXIMAB INTRAVENOSO A SUBCUTÁNEO
Nuestro grupo de trabajo ha presentado resultados preliminares en el Congreso de la Sociedad Valenciana de Patología Digestiva celebrado en noviembre de 2021, y en la actualidad disponemos ya de los datos de 13 pacientes diagnosticados de EII que se encontraban en remisión a los que se les modificó el tratamiento de mantenimiento con IFX IV (5 mg/kg cada 8 semanas) a IFX SC (120 mg cada 2 semanas). Se compararon los datos basales correspondientes a IFX IV con los obtenidos en la semana 24 tras el cambio a IFX SC. Los resultados obtenidos no mostraron diferencias entre las determinaciones de PCR basal (IFX IV) y en la semana 24 (IFX SC) (0,55 mg/dL vs 0,57 mg/dL; p > 0,05). El valor de CF se mantuvo estable por debajo de 200 ug/mg tanto en la determinación basal como en la semana 24 (32 µg/g vs 20 µg/g). Los índices clínicos de actividad (Harvey-Bradshaw e índice de Mayo parcial) se mantuvieron en valores de remisión clínica en ambas determinaciones. Se objetivó un incremento significativo de los niveles de fármaco en la semana 24 tras el cambio a IFX SC (3,99 µg/ml vs 17,00 µg/ml; p < 0,01) (Figura 1). No se registró ningún efecto adverso grave que condicionara la suspensión del fármaco. No hubo ningún cambio de tratamiento por pérdida de eficacia o complicaciones.
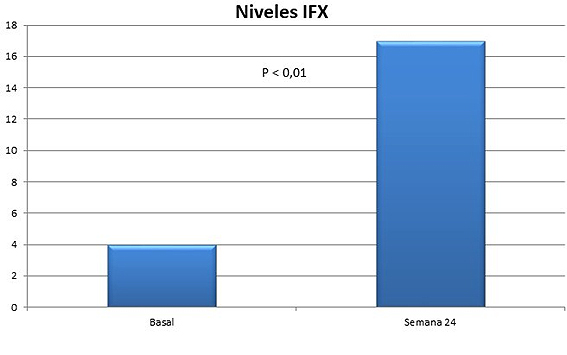
Figura 1. Niveles plasmáticos tras el cambio a infliximab subcutáneo
Elaboración propia
Nuestros resultados son concordantes con los datos publicados en los estudios previos, mostrando la eficacia y seguridad del cambio a IFX SC en los pacientes con EII, alcanzando además niveles séricos del fármaco significativamente superiores con la formulación subcutánea respecto a la intravenosa.
Con estos resultados se nos abren unas nuevas ventanas de oportunidad en el manejo del IFX subcutáneo y que deberán ser exploradas adecuadamente y generar la suficiente evidencia para su aplicación y utilización en la práctica clínica habitual.
VENTANAS DE OPORTUNIDAD CON EL MANEJO DE REMSIMA® SUBCUTÁNEO
En primer lugar, y a la vista de los resultados de los niveles plasmáticos alcanzados con la formulación subcutánea, se plantea la posibilidad de utilizar el fármaco subcutáneo en pacientes estables clínicamente a los que se les había intensificado previamente el tratamiento con IFX intravenoso. En esta situación clínica, disponemos en nuestro grupo de resultados preliminares (todavía no publicados) a 12 semanas de seguimiento de 13 pacientes en tratamiento de mantenimiento con IFX IV intensificado a los que se les había cambiado a IFX SC (Tabla 1). No se observan diferencias significativas tanto en los biomarcadores de inflamación (PCR y CF) como en los índices clínicos de actividad (Harvey-Bradshaw e índice de Mayo parcial) tras el cambio a la formulación SC.

Tabla 1. Características basales de pacientes con IFX IV intensificado que pasaron a IFX SC (CU: colitis ulcerosa / EC: Enfermedad de Crohn)
Elaboración propia
Además, se objetiva un incremento estadísticamente significativo de los niveles de fármaco en la semana 12 tras el cambio a IFX SC (10,09 µg/ml vs 13,72 µg/ml; p < 0,01). No se ha registrado ningún efecto adverso grave que condicionara la suspensión del fármaco.
Un segundo escenario que se abre también en base a los niveles plasmáticos alcanzados con el fármaco subcutáneo es su optimización con el espaciado de la dosis en lugar de cada 2 semanas, para ser administrado cada 3 o cada 4 semanas. Necesitaremos evidencias sólidas para poder trasladar esta actitud a nuestra práctica clínica. En este momento en nuestro grupo hemos consensuado esta estrategia con algunos pacientes, aunque todavía no disponemos de seguimiento a largo plazo.
El tercer escenario es el uso de la vía subcutánea en pacientes con enfermedad perianal. En esta situación clínica disponemos de datos que indican que serían necesarios unos niveles plasmáticos mayores que en la enfermedad luminal para conseguir una adecuada respuesta11,12. A la vista de los resultados tanto del ensayo clínico como de los datos de práctica clínica en los que los niveles plasmáticos alcanzados son altamente superiores a la vía intravenosa, parece razonable que en esta situación clínica también podría posicionarse la vía subcutánea.
Se trata, por lo tanto, de unos escenarios que desde el punto de vista clínico y de resultados en eficacia y seguridad son muy interesantes; ganan además fuerza si evaluamos las dos formas de administración desde un punto de vista económico. Está claro que, con la estrategia subcutánea, el ahorro en costes indirectos podría ser elevado (recursos del hospital día, horas perdidas de trabajo, etc.)
CONCLUSIONES
La aparición de IFX SC supone un nuevo avance en el tratamiento de los pacientes con EII, siendo una herramienta útil y segura, que nos permite ajustarnos a las características y preferencias individuales de los pacientes. Con los niveles alcanzados con la formulación subcutánea se abren unas expectativas de manejo del fármaco muy atractivas (utilización en pacientes intensificados, en pacientes con enfermedad perianal y espaciado de dosis en pacientes estables) que deberán de confirmarse con estudios adecuados.
Bibliografía
1. Targan SR, Hanauer SB, van Deventer SJ, et al. A short-term study of chimeric monoclonal antibody cA2 to tumor necrosis factor alpha for Crohn’s disease. Crohn’s Disease cA2 Study Group. N Engl J Med. 1997;337(15):1029-1035. doi:10.1056/NEJM199710093371502
2. Rutgeerts P, D’Haens G, Targan S, et al. Efficacy and safety of retreatment with anti-tumor necrosis factor antibody (infliximab) to maintain remission in Crohn’s disease. Gastroenterology. 1999;117(4):761-769. doi:10.1016/s0016-5085(99)70332-x
3. Hanauer SB, Feagan BG, Lichtenstein GR, et al. Maintenance infliximab for Crohn’s disease: the ACCENT I randomised trial. Lancet. 2002;359(9317):1541- 1549. doi:10.1016/S0140-6736(02)08512-4
4. Cohen RD. The pharmacoeconomics of biologic therapy for IBD. Nat Rev Gastroenterol Hepatol. 2010;7(2):103-109. doi:10.1038/nrgastro.2009.232
5. Kim JW, Lee CK, Lee JK, et al. Long-term evolution of direct healthcare costs for inflammatory bowel diseases: a population-based study (2006-2015). Scand J Gastroenterol. 2019;54(4):419-426. doi:10.1080/00365521.2019.1591498
6. Jørgensen KK, Olsen IC, Goll GL, et al. Switching from originator infliximab to biosimilar CT-P13 compared with maintained treatment with originator infliximab (NOR-SWITCH): a 52-week, randomised, double-blind, non-inferiority trial [published correction appears in Lancet. 2017 Jun 10;389(10086):2286]. Lancet. 2017;389(10086):2304-2316. doi:10.1016/S0140-6736(17)30068-5
7. Schreiber S, Ben-Horin S, Leszczyszyn J, et al. Randomized Controlled Trial: Subcutaneous vs Intravenous Infliximab CT-P13 Maintenance in Inflammatory Bowel Disease. Gastroenterology. 2021;160(7):2340-2353. doi:10.1053/j.gastro.2021.02.068.
8. Smith, P. J., Storey, D., Gregg, B., P496 Efficacy and safety of elective switching of inflammatory bowel disease patients from intravenous to subcutaneous infliximab (IFX): a multi-centre cohort study. Journal of Crohn’s and Colitis, 15(Supplement_1), S480-S481. https://doi.org/10.1093/ecco-jcc/jjab076.619
9. Verma AM, Patel A, Subramanian S, Smith PJ. From intravenous to subcutaneous infliximab in patients with inflammatory bowel disease: a pandemic-driven initiative. Lancet Gastroenterol Hepatol. 2021;6(2):88-89. doi:10.1016/S2468-1253(20)30392-7
10. Argüelles-Arias F, Fernández Álvarez P, Castro Laria L, et al. Switch to infliximab subcutaneous during SARS-CoV-2 pandemic: preliminary results [published online ahead of print, 2021 Sep 14]. Rev Esp Enferm Dig. 021;10.17235/reed.2021.8320/2021. doi:10.17235/reed.2021.8320/2021
11. Papamichael K, Vande Casteele N, Jeyarajah J, Jairath V, Osterman MT, Cheifetz AS. Higher Postinduction Infliximab Concentrations Are Associated With Improved Clinical Outcomes in Fistulizing Crohn's Disease: An ACCENT-II Post Hoc Analysis. Am J Gastroenterol. 2021;116(5):1007-1014. doi:10.14309/ajg.0000000000001111
12. Yarur AJ, Kanagala V, Stein DJ, et al. Higher infliximab trough levels are associated with perianal fistula healing in patients with Crohn's disease. Aliment Pharmacol Ther. 2017;45(7):933-940. doi:10.1111/apt.13970




