Redacción Farmacosalud.com
Los resultados positivos del ensayo fase III TOPAZ-1 mostraron que durvalumab, en combinación con quimioterapia estándar, demostró un beneficio en la supervivencia global (SG) estadística y clínicamente significativo versus quimioterapia como tratamiento de primera línea para pacientes con cáncer avanzado de vías biliares, informa AstraZeneca. En un análisis intermedio predefinido, el Independent Data Monitoring Committee concluyó que el ensayo alcanzó el objetivo primario al demostrar una mejoría en la SG en pacientes tratados con la combinación versus quimioterapia. La combinación también demostró una mejoría en la supervivencia libre de progresión (SLP) y en la tasa de respuesta global, que son objetivos secundarios clave.
La combinación tuvo un perfil de seguridad tolerable similar versus el brazo comparador y no incrementó la tasa de interrupción debido a los eventos adversos en comparación con la quimioterapia.

Autor/a de la imagen: Enric Arandes / www.farmacosalud.com
Fuente: E. Arandes / www.farmacosalud.com
Un cáncer raro y agresivo
El cáncer biliar es un grupo de cánceres raros y agresivos que ocurren en las vías biliares y en la vesícula biliar1,2. La incidencia a menudo depende de la prevalencia de factores de riesgo comunes para cada tipo dentro de una región geográfica. Aproximadamente 50.000 personas en Estados Unidos, Europa y Japón, y alrededor de 210.000 personas en todo el mundo son diagnosticadas cada año con cáncer de vías biliares3-6. Estos pacientes tienen un mal pronóstico, solo entre el 5% y 15% de todos los diagnosticados con esta enfermedad sobreviven a los cinco años4. En diciembre de 2020, durvalumab recibió la designación de medicamento huérfano en Estados Unidos para el tratamiento del cáncer de vías biliares. Este fármaco está aprobado para el tratamiento del cáncer de pulmón no microcítico (CPNM) localmente avanzado, no resecable que exprese PD-L1 y cuya enfermedad no haya presentado progresión después de quimiorradioterapia basada en platino7.
Do-Youn Oh, Prof. de la división de Oncología Médica en el departamento de Medicina Interna del Hospital de la Universidad Nacional de Seúl y de la Facultad de Medicina de la Universidad Nacional de Seúl, e investigador principal en el ensayo TOPAZ-1 Fase III, explica que "los pacientes con cáncer avanzado de vías biliares necesitan nuevos tratamientos, ya que los avances terapéuticos en la primera línea se han mantenido estancados durante más de 10 años. TOPAZ-1 es un ensayo de fase III que muestra que añadir una inmunoterapia a la quimioterapia estándar ofrece un beneficio significativo de supervivencia global para estos pacientes. Estos resultados son un gran paso adelante en el tratamiento de esta enfermedad y representan una nueva esperanza para nuestros pacientes".
El cáncer de vías biliares es un grupo de cánceres gastrointestinales raros y agresivos que se forman en las células de los conductos biliares (colangiocarcinoma), la vesícula biliar o la ampolla de Vater (donde el conducto biliar y el conducto pancreático se conectan al intestino delgado)1,2. El colangiocarcinoma es más común en China y Tailandia y está en aumento en los países occidentales8-10. El cáncer de la vesícula biliar es más común en ciertas regiones de América del Sur, India y Japón11,12.
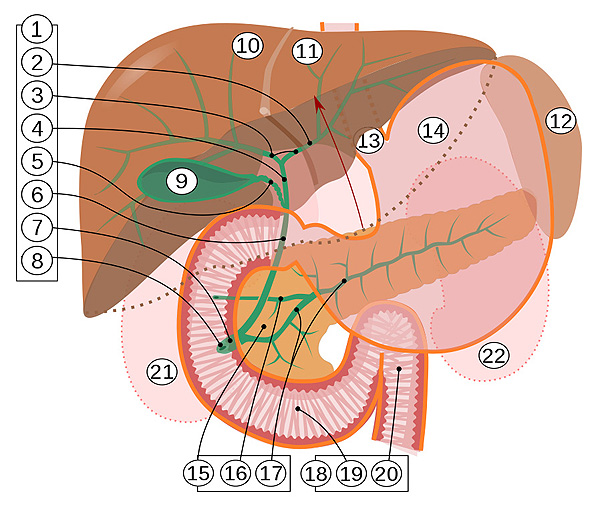
1. Vías biliares: 2. Conducto biliar intrahepático 3. Conductos hepáticos derecho e izquierdo 4. Conducto hepático común 5. Conducto cístico 6. Colédoco o Conducto biliar común 7. Ampolla de Vater o hepatopancreática 8. Carúncula mayor o Papila de Vater 9. Vesícula biliar 10-11. Lóbulos derecho e izquierdo del hígado. 12. Bazo 13. Esófago. 14. Estómago. 15. Páncreas: 16: Conducto de Santorini o pancreático accesorio 17: Conducto de Wirsung o pancreático. 18. Intestino delgado: 19. Duodeno 20. Yeyuno 21-22: Riñones derecho e izquierda (siluetas)
El borde anterior del hígado está levantado hacia arriba (flecha en marrón). Sección longitudinal de la vesícula biliar, y frontal del duodeno y páncreas. Estómago y conductos intrahepáticos en transparencia
Autor/a de la imagen: Jmarchn
Fuente: Wikipedia
Además del ampuloma, el cáncer de vías biliares en etapa temprana a menudo se presenta sin síntomas y, por lo tanto, la mayoría de los casos nuevos se diagnostican en una etapa avanzada, cuando las opciones de tratamiento son limitadas y el pronóstico es malo13-15.
Durvalumab: se une a PD-L1 y bloquea la interacción de PD-L1 con PD-1 y CD80
TOPAZ-1 es un ensayo aleatorizado, doble ciego, controlado con placebo, multicéntrico, global en fase III de durvalumab en combinación con quimioterapia (gemcitabina más cisplatino) versus placebo en combinación con quimioterapia como tratamiento de primera línea en 685 pacientes con cáncer de vías biliares avanzado o metastásico irresecable, incluido el colangiocarcinoma intrahepático y extrahepático, y el cáncer de vesícula biliar (se excluyó el ampuloma). El ensayo se está llevando a cabo en más de 145 centros en 17 países, incluidos Estados Unidos, Europa, América del Sur y varios países de Asia, incluidos Corea del Sur, Tailandia, Japón, Taiwán y China. El criterio de valoración primario es la SG y los criterios de valoración secundarios clave incluyen la supervivencia libre de progresión, la tasa de respuesta objetiva y la seguridad.
Durvalumab es un anticuerpo monoclonal humano que se une a PD-L1 y bloquea la interacción de PD-L1 con PD-1 y CD80, neutralizando la evasión inmunológica del tumor y desencadenando la inhibición de las respuestas inmunitarias16.
Se trata de una inmunoterapia aprobada en monoterapia en adultos para el tratamiento del cáncer de pulmón no microcítico (CPNM) localmente avanzado, no resecable, cuyos tumores expresan PD-L1 ≥ 1% en las células tumorales y cuya enfermedad no haya presentado progresión después de quimiorradioterapia basada en platino7,16.
Referencias
1. Marcano-Bonilla L, et al. Biliary tract cancers: epidemiology, molecular pathogenesis and genetic risk associations. CCO. 2016;5(5).
2. ESMO. What is Biliary Tract Cancer. Available here. Accessed October 2021.
3. Siegel RL, Cancer statistics, 2020. CA Cancer J Clin 2020;70:7-30.
4. ECIS - European Cancer Information System. Disponible en https://know.az/3vNb7Rp. Último acceso: octubre de 2021.
5. Kohei Nakachi, et al. Hepatobiliary and Pancreatic Oncology Group of the Japan Clinical Oncology Group, A randomized Phase III trial of adjuvant S-1 therapy vs. observation alone in resected biliary tract cancer: Japan Clinical Oncology Group Study (JCOG1202, ASCOT), Japanese Journal of Clinical Oncology. 2018,48:392-395.
6. GBD 2017 Disease and Injury Incidence and Prevalence Collaborators. Global, regional, and national incidence, prevalence, and years lived with disability for 354 diseases and injuries for 195 countries and territories, 1990-2017: a systematic analysis for the Global Burden of Disease Study 2017. Lancet. 2018;392(10159):1789-1858.
7. Turkes F, et al. Contemporary Tailored Oncology Treatment of Biliary Tract Cancers. Gastroenterol Res Pract. 2019;2019:7698786.
8. Banales JM, Cardinale V, Carpino G, et al. Cholangiocarcinoma: current knowledge and future perspectives consensus statement from European network for the study of cholangiocarcinoma (ENS-CCA). Nat Rev Gastroenterol Hepatol. 2016;13:261-280.
9. Kirstein MM, Vogel A. Epidemiology and risk factors of cholangiocarcinoma. Visc Med. 2016;32:395-400.
10. Khan SA, Tavolari S, Brandi G. Cholangiocarcinoma: epidemiology and risk factors. Liver International. 2019;39(Suppl.1):19-31.
11. Bridgewater JA, Goodman KA, Kalyan A, et al. Biliary tract cancer: epidemiology, radiotherapy, and molecular profiling. Am Soc Clin Oncol Educ Book. 2016;35:194-203.
12. Torre LA, Siegel RL, Islami F, et al. Worldwide burden of and trends in mortality from gallbladder and other biliary tract cancers. Clin Gastroenterol Hepatol. 2018;16:427-437.
13. Banales JM, et al. Cholangiocarcinoma 2020: the next horizon in mechanisms and management. Nature Reviews Gastroenterology & Hepatology. 2020; 17: 557-588.
14. He XD, et al. Association of metabolic syndromes and risk factors with ampullary tumors development: A case-control study in China. World J Gastroenterol. 2014; 20(28): 9541-9548.
15. WHO. World Cancer Fact Sheet. Disponible en https://gco.iarc.fr/today/data/factsheets/populations/900-world-fact-sheets.pdf. Último acceso: octubre de 2021.
16. Ficha Técnica IMFINZI (Durvalumab). Disponible en: https://cima.aemps.es/cima/dochtml/ft/1181322001/FT_1181322001.html - Ultimo acceso octubre de 2021.




