Introducción
El siglo pasado ha sido testigo de cómo nuestras sociedades modernas desarrolladas han adoptado cambios dramáticos en su estilo de vida y en sus hábitos alimenticios. Estos cambios se caracterizan por una actividad física limitada junto con una alimentación excesiva, con alimentos ricos en grasas, carne procesada, azúcares, sal y granos refinados, al tiempo que son bajos en frutas y verduras. Todo ello ha sido factor determinante en el desarrollo de enfermedades crónicas no transmisibles.
El aumento mundial de la prevalencia de la obesidad y el incremento significativo de personas con diabetes son fenómenos que acarrean importantes consecuencias médicas y económicas. La decepcionante eficacia de las intervenciones dietéticas para la obesidad y sus complicaciones puede deberse a la falta de consideración de las variabilidades interindividuales en las respuestas dietéticas. De hecho, algunas de las respuestas metabólicas a la dieta difieren de un individuo a otro, como lo demuestra el metabolismo del colesterol y la hiperglucemia postprandial, y los factores de riesgo para las enfermedades cardiovasculares y la diabetes tipo 2. Estudios recientes demuestran que no todos los individuos responden de la misma manera a los cambios en el estilo de vida, y esto ciertamente se aplica a los cambios en el régimen alimenticio. Los factores fundamentales sugeridos para determinar la respuesta individualizada a los alimentos y las implicaciones biológicas de su consumo incluyen nuestro microbioma y las variaciones interpersonales en una variedad de exposiciones ambientales y factores de estilo de vida.
Fuente: Archivo
La microbiota intestinal es el conjunto de microorganismos que habitan en el tracto intestinal humano. En el sistema digestivo, existen más de mil especies bacterianas. Ahora se sabe que estas bacterias no son simplemente organismos comensales en nuestros cuerpos, sino que sirven como un importante ‘órgano’ que regula los procesos metabólicos, incluyendo la digestión y absorción de nutrientes, la síntesis de vitaminas y la modulación de la inmunidad de la mucosa, así como la producción de toxinas y carcinógenos. La composición de la comunidad microbiana intestinal determina la naturaleza de su influencia en numerosas condiciones fisiológicas y patológicas.
Dado que el perfil microbiano intestinal es único para cada individuo, evoluciona a lo largo de la vida y puede ser alterado por factores internos y externos (especialmente la dieta), el microbioma intestinal presenta nuevas oportunidades para la nutrigenómica y la nutrición personalizada. La microbiota intestinal puede influir en la expresión de genes tanto local como sistémicamente. A través de las interacciones con el tejido de la mucosa intestinal, ciertas especies de bacterias pueden influir en la expresión de los genes implicados en la absorción de nutrientes o en la función inmunitaria, mientras que algunas sustancias generadas por las bacterias intestinales pueden entrar en el torrente sanguíneo; por ejemplo, los ácidos grasos de cadena corta (producidos por la fermentación de polisacáridos) pueden regular la expresión génica de la lipogénesis en el hígado, y las toxinas y los lipopolisacáridos pueden afectar a los genes relacionados con la inflamación.
Estos hallazgos son ejemplos que ilustran una nueva interfaz para la regulación de la expresión génica por los nutrientes de la dieta, y también revelan una vía alternativa para regular la expresión génica a través de la manipulación de la microbiota intestinal. La contribución genética al riesgo de enfermedades ha sido conocida y estudiada durante décadas, mientras que la contribución comensal de la microbiota -ignorada hasta hace poco- es cada vez más apreciada por su aportación a las respuestas individualizadas a los alimentos, e incluso para vincular una variedad de factores ambientales a la fisiología del huésped.
Fuente: Archivo
La inclusión del microbioma como elemento necesario para explicar la singularidad personal, ha llevado a un cambio de paradigma en términos de nuestra comprensión de la variabilidad interindividual y cómo ésta influye en las respuestas a los factores ambientales (como la dieta). Los recientes avances en la investigación de la microbiota intestinal, enfatizan el potencial de modificar la composición de las bacterias intestinales como una intervención novedosa y efectiva, tanto para el manejo de enfermedades como para la promoción de la salud.
Nutrición de precisión
El Instituto Central Lechera Asturiana para la Nutrición Personalizada aúna el aval de la Cátedra de Nutrición y Salud de la Universidad Complutense, la especialización en microbiología de los científicos de Darwin Bioprospecting Excellence, el soporte tecnológico de SNGULAR, y la experiencia y conocimientos en alimentación de la empresa láctea líder en España, CAPSA FOOD. 39ytú es el primer proyecto del Instituto basado en la recomendación nutricional de precisión tras la realización de un test del microbioma mediante la secuenciación genética de la microbiota. Su nombre hace alusión a los 39 billones de bacterias que colonizan el intestino y que conforman la microbiota.
El desarrollo de intervenciones dietéticas con probióticos y complementos alimenticios, basados en el perfil individual de cada persona para optimizar la composición microbiana del intestino, es una práctica importante para la nutrición personalizada. Las tecnologías desarrolladas por el Instituto Central Lechera Asturiana permiten determinar con rapidez y precisión el perfil microbiano del intestino, lo que a su vez posibilita poder monitorear fácilmente los cambios personales en la composición de las bacterias intestinales durante el desarrollo de la enfermedad y en el curso de la intervención.
Fuente: CAPSA
El equipo de nutricionistas, investigadores y médicos del Instituto han seleccionado siete problemas de salud sobre los que hay evidencia científica de que una dieta equilibrada y el aporte de soluciones nutricionales con probióticos y otros ingredientes bioactivos pueden actuar y modificar la composición de la microbiota: intolerancia al gluten, reducción del colesterol, control de glucosa, disconfort digestivo, disconfort intestinal, mejora de las defensas y regularidad intestinal.
Mediante un test del microbioma, se realiza un análisis basado en el ADN de los microorganismos del intestino para conocer la diversidad de bacterias que existen y, así, detectar posibles alteraciones relacionadas con las siete dianas de salud seleccionadas. A partir del análisis, el equipo médico del Instituto realiza una recomendación de hábitos saludables, así como la prescripción de una solución individualizada de precisión, con una selección de probióticos e ingredientes activos dirigidos a la mejora de las deficiencias nutricionales y a la recuperación de un buen balance de la microbiota.
Las soluciones bioactivas son complementos alimenticios en los que se combinan microorganismos vivos, o lo que es lo mismo, probióticos, con ingredientes bioactivos. Existen siete soluciones bioactivas diferentes, diseñadas en relación a las alteraciones de salud más prevalentes en España, como son: colesterol, diabetes, regularidad intestinal, disconfort intestinal, disconfort digestivo e inmunidad. Cada solución contiene un probiótico especifico e ingredientes bioactivos que poseen efectos beneficiosos sobre la diana en concreto. La formulación exclusiva de los complementos de 39ytú -junto a una dieta variada y equilibrada y un estilo de vida saludable- ayuda a alcanzar una nutrición balanceada con la que favorecer una microbiota intestinal más saludable.
DBT-15-FRESA- CONTROL DE GLUCOSA
Es un complemento alimenticio para la mejora del control de glucosa. Contiene ashwaganda[1-3], Bifidobacterium lactis BPL-1[4-7], cromo[8], trans resveratrol[9-11] y pinitol[12,13]. No contiene grasa ni azúcares añadidos y aporta proteína láctea.
Ingredientes: leche desnatada en polvo, concentrado de proteína sérica (leche), almidón modificado, agente de carga (maltodextrina), acidulante (ácido cítrico), extracto de fruta de Ceratonia siliqua L. (algarroba), aroma de fresa, extracto de planta entera de Ashwagandha (Withania somnífera (L.) Duna), extracto de hoja de Vitis vinifera L. (uva), colorante (ácido carmínico), edulcorante (sucralosa), picolinato de cromo y Bifidobacterium lactis BPL-1.
Un estudio realizado en humanos[7] evidenció los efectos del probiótico Bifidobacterium animalis subsp. lactis CECT 8145 demostrando que redujo la circunferencia de la cintura (cm), en comparación con el grupo placebo. Mediciones: grasa visceral abdominal (Imágenes de Resonancia Magnética (IRM)), presión arterial y adiposidad, la glucosa, los lípidos, la insulina y la proteína C reactiva, y análisis de microbioma intestinal.
![Gráfica 1. Resultados sobre la reducción de perímetro de la cintura tras la ingesta de Bifidobacterium animalis subsp. lactis BPL1[7]](http://farmacosalud.com/wp-content/uploads/2019/05/tabla-1-okok.jpg)
Gráfica 1. Resultados sobre la reducción de perímetro de la cintura tras la ingesta de Bifidobacterium animalis subsp. lactis BPL1[7]
CEL-15-FRESA- INTOLERANCIA AL GLUTEN
Es un complemento alimenticio indicado para transgresiones accidentales de la dieta sin gluten. Contiene ashwaganda[1-3], Bifidobacterium longum ES1[14-16], Tolerase G®[17-20] (enzima autorizada por EFSA y capaz de romper el gluten), tiene alto contenido en fibra y vitaminas y minerales[21,22]. Sin grasa, sin azúcares añadidos, con proteína láctea.
Se debe administrar en una dieta estricta sin gluten.
Ingredientes: leche desnatada en polvo sin lactosa, almidón modificado, fibra, concentrado de proteína sérica (leche), acidulante (ácido cítrico), agente de carga (maltodextrina), aroma de fresa, Enzima Prolil-oligopeptidasa (Tolerase G®), extracto de planta entera de Ashwagandha (Withania somnífera (L.) Duna), sales minerales (pirofosfato de hierro, selenito sódico, sulfato de zinc), edulcorante (sucralosa), vitaminas (L-ascorbato de sodio, acetato de tocoferol, retinil acetato, colecalciferol, pantotenato cálcico, clorhidrato de piridoxina, tiamina mononitrato, cianocobalamina), colorante (ácido carmínico) y Bifidobacterium longum ES1.
![Gráfica 2. Cambios en la composición de la microbiota intestinal estimada como la diferencia entre el valor de referencia y el valor post-intervención, dividido por el valor de referencia del placebo y Bifidobacterium longum CECT 7347 durante los 3 meses de intervención junto con la dieta sin gluten.<br srcset= Gráfica 2. Cambios en la composición de la microbiota intestinal estimada como la diferencia entre el valor de referencia y el valor post-intervención, dividido por el valor de referencia del placebo y Bifidobacterium longum CECT 7347 durante los 3 meses de intervención junto con la dieta sin gluten. * El valor medio fue significativamente diferente a la del grupo placebo[16]](http://farmacosalud.com/wp-content/uploads/2019/06/gráfica-2-ok-número.jpg)
* El valor medio fue significativamente diferente a la del grupo placebo[16]" width="450" height="409"> Gráfica 2. Cambios en la composición de la microbiota intestinal estimada como la diferencia entre el valor de referencia y el valor post-intervención, dividido por el valor de referencia del placebo y Bifidobacterium longum CECT 7347 durante los 3 meses de intervención junto con la dieta sin gluten.
* El valor medio fue significativamente diferente a la del grupo placebo[16]
Un estudio realizado en niños con B. longum CECT 7347, doble ciego, aleatorio y controlado reveló que los números de copias de genes del grupo de B. fragilis aumentaron significativamente en el grupo de placebo en comparación con el del grupo B. longum CECT 7347[16].
Los resultados de un estudio doble ciego controlado por placebo mostraron que tanto una dosis baja como alta de Tolerase G®, reduce significativamente las concentraciones de gluten en el estómago y el duodeno de individuos sensibles al gluten. En la gráfica 3 puede observarse la reducción del gluten en comparación con el placebo[20].
![Gráfica 3. Degradación por la Tolerase G® en el estómago y duodeno de voluntarios humanos[20] (e) F2 letra pequeña](http://farmacosalud.com/wp-content/uploads/2019/06/e-F2-letra-pequeña.jpg)
COL-15-FRESA- REDUCE EL COLESTEROL
Es un complemento alimenticio que reduce el colesterol. Contiene ashwaganda[1-3], Lactobacillus plantarum LP LDL®[23-26], esteroles vegetales[27,28], ácidos grasos omega 3[29] y vitamina E[30]. Sin grasa, sin azúcares añadidos, con proteína láctea.
Ingredientes: leche desnatada en polvo sin lactosa, almidón modificado, esteroles vegetales (10%), concentrado de proteína sérica (leche), agente de carga (maltodextrina), aceite de pescado rico en EPA y DHA, (leche, soja) acidulante (ácido cítrico), extracto de planta entera de Ashwagandha (Withania somnifera (L.) Duna), aroma de fresa, edulcorante (sucralosa), colorante (ácido carmínico), vitamina E natural y Lactobacillus plantarum LP LDL®.
En el año 2017 un estudio de la University of Reading (United Kingdom)[4] confirma la seguridad de Lactobacillus plantarum LP LDL® y demuestra que puede impactar, positivamente, en los perfiles lipídicos y en la sangre, ambos factores de riesgo cardiovascular muy significativos[23].
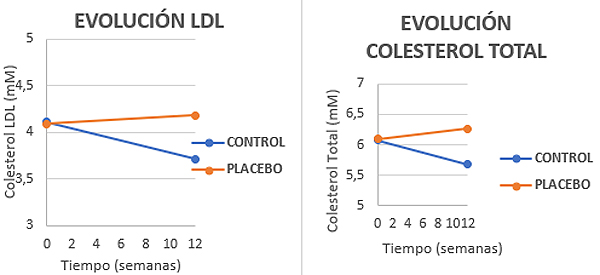
Lactobacillus plantarum LPL DL® sobre el Colesterol LDL y Colesterol Total" width="600" height="275"> Gráfica 4. Resultados de la ingesta de Lactobacillus plantarum LPL DL® sobre el Colesterol LDL y Colesterol Total
FIB-15-FRESA- REGULARIDAD INTESTINAL
Es un complemento alimenticio enfocado a la mejora de la regularidad intestinal. Contiene ashwaganda[1-3], Bifidobacterium lactis HN019[31-33], y con un alto contenido en fibra[34-36]. Sin grasa, sin azúcares añadidos, con proteína láctea.
Ingredientes: fibra (Maltodextrina Resistente a la Digestión: Fibersol®-2), leche desnatada en polvo sin lactosa, almidón modificado, acidulante (ácido cítrico), aroma de fresa, extracto de planta entera de Ashwagandha (Withania somnifera (L.) Duna), edulcorante (sucralosa), colorante (ácido carmínico) y Bifidobacterium lactis HN019.
Un estudio realizado en el año 2011[33] demuestra que el suplemento de B. lactis HN019 es bien tolerado, disminuye el tiempo de tránsito intestinal de manera dependiente de la dosis y, además, reduce la frecuencia de los síntomas gastrointestinales funcionales en adultos.
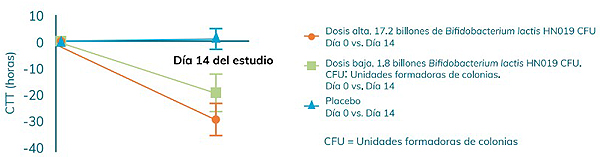
Bifidobacterium lactis HN019 frente al grupo placebo[33]" width="600" height="157"> Gráfica 5. Cambios en los tiempos de tránsito intestinal (CTT) tras 14 días de ingesta de dos dosis distintas de Bifidobacterium lactis HN019 frente al grupo placebo[33]
II-15-FRESA- DISCONFORT INTESTINAL
Es un complemento alimenticio dirigido a la mejora del disconfort intestinal. Contiene ashwaganda[1-3], Bifidobacterium longum ES1[37-41], cloruros[42], extracto de flores de lavanda[43], glutamina[44-46], y ácidos grasos omega 3[47]. Sin grasa, sin azúcares añadidos, con proteína láctea.
Ingredientes: leche desnatada en polvo sin lactosa, almidón modificado, fibra alimentaria, concentrado de proteína sérica (leche), aceite de pescado rico en omega 3 (EPA+DHA) (leche, soja), glutamina, acidulante (ácido cítrico), agente de carga (maltodextrina), aroma de fresa, sales minerales (pirofosfato de hierro, selenito sódico, sulfato de zinc, cloruro potásico), extracto de planta entera de Ashwagandha (Withania somnifera (L.) Duna), extracto de flores de lavanda (Lavandula angustifolia), edulcorante (sucralosa), colorante (ácido carmínico), vitaminas (L-ascorbato de sodio, acetato de tocoferol, retinil acetato, colecalciferol, pantotenato cálcico, clorhidrato de piridoxina, tiamina mononitrato, cianocobalamina) y Bifidobacterium longum ES1.
En estudios celulares de mucina y Caco-2 se determinó la adhesión de Bifidobacterium longum ES1 CECT 7347 comprobándose que reduce la respuesta inflamatoria mediada por interleucina-1β[41].
![Gráfica 6. Expresión del mRNA de marcadores pro-inflamatorios (TNF-α, NK-kβ) y receptor de quimiocina (CXR3) en cultivos celulares Caco2 expuestos a fracciones dializadas de gliadinas digeridas (Gld), inoculados o no con distintas bifidobacterias[41]](http://farmacosalud.com/wp-content/uploads/2019/05/tabla-5.jpg)
Gráfica 6. Expresión del mRNA de marcadores pro-inflamatorios (TNF-α, NK-kβ) y receptor de quimiocina (CXR3) en cultivos celulares Caco2 expuestos a fracciones dializadas de gliadinas digeridas (Gld), inoculados o no con distintas bifidobacterias[41]
DIG-15- FRESA - DISCONFORT DIGESTIVO
Es un complemento alimenticio enfocado a la mejora del disconfort digestivo. Contiene ashwaganda[1-3], Lactobacillus acidophilus NCFM®[48-50], lactasa[51], calcio[42], extracto de manzanilla, hinojo y menta[52-54] y bromelaína[55]. Sin grasa, sin azúcares añadidos, con proteína láctea.
Ingredientes: leche desnatada en polvo sin lactosa, almidón modificado, agente de carga (maltodextrina), concentrado de proteína sérica (leche), extracto de fruta de Ananas comosus (L.) Merr. (piña), acidulante (ácido cítrico), extracto de planta entera de Ashwagandha (Withania somnifera (L.) Duna), extracto de partes aéreas de Chamaemelum nobile (L.) All. (camomila), extracto de partes aéreas de Foeniculum vulgare Mill. (hinojo), extracto de partes aéreas de Mentha x piperita L. (menta), lactato cálcico, cloruro potásico, aroma de fresa, lactasa, colorante (ácido carmínico), edulcorante (sucralosa) y Lactobacillus acidophilus NCFM®.
En un estudio realizado en el año 2014[50], cuyo objetivo fue investigar el mecanismo de acción de Lactobacillus acidophilus NCFM® en humanos con dolor abdominal de leve a moderado, se demostró que los grupos de intervención que se muestran en la Tabla 1 tendieron a tener mejoría en varias medidas clínicas después de las intervenciones probióticas, incluidas las puntuaciones de gravedad de los síntomas de FBD (IBS-SSS), la gravedad de la distensión, el número de evacuaciones intestinales diarias, el bienestar diario y el número de días con dolor abdominal. De manera interesante, el grupo L-NCFM® tuvo una disminución estadísticamente significativa en el número de evacuaciones diarias, algo que no se observó en el grupo de probióticos duales.
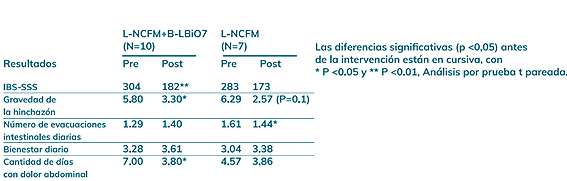
Tabla 1. Mejoras en diversas medidas clínicas tras las intervenciones con probióticos, incluyendo puntuaciones en la severidad de los síntomas de enfermedad funcional intestinal (IBS-SSS), severidad de la hinchazón, número de movimientos intestinales diarios (BMs), bienestar diario y número de días con dolor abdominal. L-NCFM: Lactobacillus acidophilus NCFM® / B-LBi07: Bifidobacterium lactis Bi07
INM-15- FRESA- AYUDA A TUS DEFENSAS
Es un complemento alimenticio indicado para la mejora de las defensas. Contiene ashwaganda[1-3], Bifidobacterium lactis BL-04®[56-58], vitaminas y minerales[59-64] y extractos de equinácea y salvia[65]. Sin grasa, sin azúcares añadidos, con proteína láctea.
Ingredientes: leche desnatada en polvo sin lactosa, concentrado de proteína sérica (leche), almidón modificado, agente de carga (maltodextrina), acidulante (ácido cítrico), aroma de fresa, extracto de planta entera de Ashwagandha (Withania somnifera (L.) Duna), colorante (ácido carmínico), sales minerales (pirofosfato de hierro, selenito sódico, sulfato de zinc), edulcorante (sucralosa), extracto de raíz de Echinacea purpurea DC. (Echinacea), extracto de Salvia officinalis, vitaminas (L-ascorbato de sodio, acetato de tocoferol, retinil acetato, colecalciferol, pantotenato cálcico, clorhidrato de piridoxina, tiamina mononitrato, cianocobalamina) y Bifidobacterium lactis BL-04®.
Un estudio realizado en el año 2014[58] demuestra que la utilización preventiva del Bifidobacterium lactis BL-04® reduce la incidencia de síntomas de enfermedades del tracto respiratorio URT y por tanto puede favorecer un menor uso de antibióticos. Además, ayuda a mantener las defensas naturales del sistema inmune y las funciones respiratorias sanas.
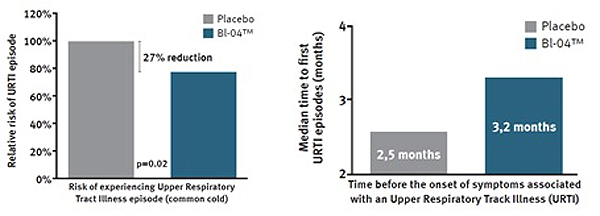
Gráfica 7. Reducción de la incidencia y tiempo en cuanto a síntomas de Enfermedades del tracto respiratorio URT tras la ingesta de Bifidobacterium lactis BL-04®
Referencias
1. Panossian A, Wikman G, Wagner H. Plant adaptogens. III. Earlier and more recent aspects and concepts on their mode of action. Phytomedicine.1999 Oct;6(4):287-300.
2. Chandrasekhar K, Kapoor J, Anishetty S. A prospective, randomized double-blind, placebo-controlled study of safety and efficacy of a highconcentration full-spectrum extract of ashwagandha root in reducing stress and anxiety in adults. Indian J Psychol Med. 2012 Jul;34(3):255-62.
3. Ambiye VR, Langade D, Dongre S, Aptikar P, Kulkarni M, Dongre A. Clinical Evaluation of the Spermatogenic Activity of the Root Extract of Ashwagandha (Withania somnifera) in Oligospermic Males: A Pilot Study. Evid Based Complement Alternat Med. 2013;2013:571420.
4. Chenoll E, Codoñer FM, Silva A, Martinez-Blanch JF, Martorell P, Ramón D, et al. Draft Genome Sequence of Bifidobacterium animalis subsp. lactis Strain CECT 8145, Able To Improve Metabolic Syndrome In Vivo. Genome Announc. 2014 Mar 27;2(2).
5. Martorell P, Llopis S, González N, Chenoll E, López-Carreras N, Aleixandre A, et al. Probiotic Strain Bifidobacterium animalis subsp.lactis CECT 8145 Reduces Fat Content and Modulates Lipid Metabolism and Antioxidant Response in Caenorhabditis elegans. J Agric Food Chem. 2016 May 4;64(17):3462-72.
6. Carreras NL, Martorell P, Chenoll E, Genovés S, Ramón D, Aleixandre A. Anti-obesity properties of the strain Bifidobacterium animalis subsp. lactis CECT 8145 in Zücker fatty rats. Benef Microbes. 2018 Jun 15;9(4):629-641.
7. Pedret A, Valls RM, Calderón-Pérez L, Llauradó E, Companys J, Pla-Pagà L, et al. Effects of daily consumption of the probiotic Bifidobacterium animalis subsp. lactis CECT 8145 on anthropometric adiposity biomarkers in abdominally obese subjects: a randomized controlled trial. Int J Obes (Lond). 2018 Sep 27.
8. EFSA Panel on Dietetic Products, Nutrition and Allergies (NDA); Scientific Opinion on the substantiation of health claims related to chromium and contribution to normal macronutrient metabolism (ID 260, 401, 4665, 4666, 4667), maintenance of normal blood glucosa concentrations (ID 262, 4667), contribution to the maintenance or achievement of a normal body weight (ID 339, 4665, 4666), and reduction of tiredness and fatigue (ID 261) pursuant to Article 13(1) of Regulation (EC) No 1924/2006. EFSA Journal 2010;8(10):1732.[23 pp.].
9. Nassiri-Asl M, Hosseinzadeh H. Review of the pharmacological effects of Vitis vinifera (Grape) and its bioactive compounds. Phytother Res. 2009 Sep;23(9):1197-204.
10. Rasines-Perea Z, Teissedre PL. Grape Polyphenols’ Effects in Human Cardiovascular Diseases and Diabetes. Molecules. 2017 22(1):68.
11. Akaberi M, Hosseinzadeh H. Grapes (Vitis vinifera) as a Potential Candidate for the Therapy of the Metabolic Syndrome. Phytother Res. 2016 Apr;30(4):540-56.
12. Bates SH, Jones RB, Bailey CJ. Insulin-like effect of pinitol. Br J Pharmacol 2000 Aug;130(8):1944-8
13. Kim MJ, Yoo KH, Kim JH, Seo YT, Ha BW, Kho JH,et al. Effect of pinitol on glucose metabolism and adipocytokines in uncontrolled type 2 diabetes. Diabetes Res Clin Pract. 2007 Sep;77 (1) :S247-51.
14. Izquierdo E, Medina M, Ennahar S, Marchioni E, Sanz Y. Resistance to simulated gastrointestinal conditions and adhesión to mucus as probiotic criteria for Bifidobacterium longum strains. Current Microbiology. 2008; 56:613-618.
15. Laparra JM, Sanz Y. Bifidobacteria inhibit the inflammatory response induced by gliadins in intestinal epithelial cells via modifications of toxic peptide generation during digestion. Journal of Cell Biochemistry. 2010; 109: 801-807.
16. Olivares M, Castillejo G, Varea V, Sanz Y. Double-blind, randomised, placebo-controlled intervention trial to evaluate the effects ofBifidobacterium longum CECT 7347 in children with newly diagnosed coeliac disease. Br J Nutr. 2014 Jul 14;112(1):30-40.
17. Janssen G. ‘Ineffective degradation of immunogenic gluten epitopes by currently available digestive enzyme supplements’ PLoS One.2015; 10: 6.
18. Mitea C, Havenaar R, Drijfhout JW, Edens L, Dekking L, Koning F. Efficient degradation of gluten by a prolyl endoprotease in a gastrointestinal model: implications for coeliac disease. Gut 2008 Jan;57(1):25-32.
19. Stepniak D, Spaenij-Dekking L, Mitea C, Moester M, de Ru A, Baak-Pablo R. Highly efficient gluten degradation with a newly identified prolyl endoprotease: implications for celiac disease. Am J Physiol Gastrointest Liver Physiol. 2006 Oct;291(4):G621-9.
20.König J, Holster S, Bruins MJ, Brummer RJ. Randomized clinical trial: Efective gluten degradation by Aspergillus niger-derived enzyme in a complex meal setting. Sci Rep. 2017 Oct 12;7(1):13100.
21. Consani S. Enfermedad celíaca. Un desafío en Medicina Interna. Arch Med Interna. 2010; 32(1):S35-S46 S47.
22. Fasano A, Catassi C. Current approaches to diagnosis and treatment of celiac disease: an evolving spectrum. Gastroenterology.2001 Feb;120(3):636-51.
23. Costabile A, Buttarazzi I, Kolida S, Quercia S, Baldini J, Swann JR, et al. An in vivo assessment of the cholesterol-lowering efficacy of Lactobacillus plantarum ECGC 13110402 in normal to mildly¡ hypercholesterolaemic adults. PLoS One 2017 Dec 11;12(12): e0187964.
24. Montagner A, Korecka A, Polizzi A, Lippi Y, Blum Y, Canlet C, et al. Hepatic circadian clock oscillators and nuclear receptors integrate microbiome-derived signals. Sci Rep. 2016;6:20127.
25. Scott A. Gut–liver axis: menace in the microbiota. Nature.2017;551:S95.
26. Lactobacillus plantarum LPLDL® For the prevention and management of cardiovascular disease. Nutrafoods. 2018; 17:N123-N21.
27. Katan MB. Efficacy and safety of plant stanols and sterols in the management of blood cholesterol levels. Mayo Clin Proc 2003; 78:965-978.
28. Reglamento (UE) No 686/2014 de la comisión de 20 de junio de 2014 por el que se modifican los Reglamentos (CE) No 983/2009 y (UE) No 384/2010 en lo que se refiere a las condiciones de uso de determinadas declaraciones de propiedades saludables relativas al efecto de los fitoesteroles y fitoestanoles en la reducción del colesterol LDL en la sangre.
29. EFSA Panel on Dietetic Products, Nutrition and Allergies (NDA). Scientific Opinion on the substantiation of health claims related to eicosapentaenoic acid (EPA), docosahexaenoic acid (DHA), do cosapentaenoic acid (Dand maintenance of normal cardiac function (ID 504, 506, 516, 527, 538, 703, 1128, 1317, 1324, 1325), maintenance of normal blood glucose concentrations (ID 566), maintenance of normal blood pressure (ID 506, 516, 703, 1317, 1324), maintenance of normal blood HDL-cholesterol concentrations (ID 506), maintenance of normal (fasting) blood concentrations of triglycerides (ID 506, 527, 538, 1317, 1324, 1325), maintenance of normal blood LDL-cholesterol concentrations (ID 527, 538, 1317, 1325, 4689), protection of the skin from photo-oxidative (UV-induced) damage (ID 530), improved absorption of EPA and DHA (ID 522, 523), contribution to the normal function of the immune system by decreasing the levels of eicosanoids, arachidonic acid-derived mediators and pro-inflammatory cytokines (ID 520, 2914),
30. EFSA Panel on Dietetic Products, Nutrition and Allergies (NDA), Scientific Opinion on the substantiation of health claims related to vitamin E and protection of DNA, proteins and lipids from oxidative damage (ID 160, 162, 1947), maintenance of the normal function of the immune system (ID 161, 163), maintenance of normal bone (ID 164), maintenance of normal teeth (ID 164), maintenance of normal hair (ID 164), maintenance of normal skin (ID 164), maintenance of normal nails (ID 164), maintenance of normal cardiac function (ID166), maintenance of normal vision by protection of the lens of the eye (ID 167), contribution to normal cognitive function (ID 182, 183),regeneration of the reduced form of vitamin C (ID 203), maintenance of normal blood circulation (ID 216)and maintenance of a normal scalp (ID 2873) pursuant to Article 13(1) of Regulation (EC) No 1924/2006. EFSA Journal 2010;8(10):1816.
31. Ibarra A, Latreille-Barbier M, Donazzolo Y, Pelletier X, Ouwehand AC. Effects of 28-day Bifidobacterium animalis subsp. Lactis HN019 supplementation on colonic transit time and gastrointestinal symptoms in adults with functional constipation: A double-blind, randomized, placebo-controlled, and dose-ranging trial. Gut Microbes. 2018;9(3):236-251.
32. Miller LE, Ouwehand AC. Probiotic supplementation decreases intestinal transit time: meta-analysis of randomized controlled trials. World J Gastroenterol. 2013 Aug 7;19(29):4718-25.
33. Waller PA, Gopal PK, Leyer GJ, Ouwehand AC, Reifer C, Stewart ME, Miller LE. Dose-response effect of Bifidobacterium lactis HN019 on whole gut transit time and functional gastrointestinal symptoms in adults. Scand J Gastroenterol. 2011 Sep;46(9):1057-64.
34. Satouchi M, Wakabayashi S, Okhuma K, et al. Effects of indigestible dextrin on bowel movements. Jpn j Nutr 1993; 51.31-37. Inaki M,Fujii S, lino H. Effects of the administration of soft drink containing indigestible dextrin on defecation frequency and fecal characteristics of Japanese healthy female volunteers. J. Nutritional Food 1999;2:44-51.
35. Satouchi M, Wakabayashi S, Okhuma K, et al. Effects of indigestible dextrin on bowel movements. Jpn j Nutr 1993; 51.31-37.
36. Watanabe N, Suzuki M, Yamaguchi Y, Egashira Y. Effects of resistant maltodextrin on bowel movements: a systematic review and meta-analysis. Clin Exp Gastroenterol. 2018;11:85-96.
37. Bai AP, Ouyang Q, Xiao XR, Li SF. Probiotics modulate inflammatory cytokine secretion from inflamed mucosa in active ulcerative colitis. International Journal of Clinical Practice. 2006;60(3):284–288.
38. Steed H, MacFarlane GT, Blackett KL, et al. Clinical trial: the microbiological and immunological effects of synbiotic consumption—a randomized double-blind placebo-controlled study in active Crohn’s disease. Alimentary Pharmacology and Therapeutics.2010;32(7):872–883.
39. Laparra JM, Sanz Y. Bifidobacteria inhibit the inflammatory response induced by gliadins in intestinal epithelial cells via modifications of toxic peptide generation during digestion. Journal of Cellular Biochemistry. 2011; 109:801–807
40. Olivares M, Laparra M, Sanz Y. Influence of Bifidobacterium longum CECT 7347 and gliadin peptides on intestinal epithelial cell proteome. J Agric Food Chem. 2011 Jul 27;59(14):7666-71.
41. Laparra JM, Olivares M, Gallina O, Sanz Y. Bifidobacterium longum CECT 7347 modulates immune responses in a gliadin-induced enteropathy animal model. PLoS One. 2012;7(2):e30744.
42. REGLAMENTO (UE) N o 432/2012 DE LA COMISIÓN de 16 de mayo de 2012 por el que se establece una lista de declaraciones autorizadas de propiedades saludables de los alimentos distintas de las relativas a la reducción del riesgo de enfermedad y al desarrollo y la salud de los niños.
43. Denner SS. Lavandula angustifolia Miller: English lavender. Holist Nurs Pract. 2009 Jan-Feb;23(1):57-64.
44.Tan H, Sun MY, Yang J. Effect of retention enema with combination of compound glutamine entero-soluble capsule and glucocorticoids for treatment of ulcerative colitis. Zhongguo Zhong Xi Yi Jie He Za Zhi 2008; 28: 645-647.
45. Bourreille A, Humbert B, Maugère P, Galmiche JP, Darmaun D. Glutamine metabolism in Crohn’s disease: a stable isotope study. Clin Nutr. 2004; 23: 1167-1175.
46. Kudsk KA, Wu Y, Fukatsu K, Zarzaur BL, Johnson CD, Wang R. et al. Glutamine enriched total parenteral nutrition maintains intestinal IL4 and mucosal IgA levels. J Parenter Enteral Nutr. 2000; 24: 270-275.
47. Castellanos L, Rodriguez M. El efecto de omega 3 en la salud humana y consideraciones en la ingesta. Rev Chil Nutr. 2015; 42(1).
48. Montes RG, Bayless TM, Saavedra JM, Perman JA. Effect of Milks Inoculated with Lactobacillus acidophilus or a Yogurt Starter Culture in Lactose-Maldigesting Children. J Dairy Sci.1995 Aug;78(8):1657 – 1664
49. Paineau D, Carcano D, Leyer G, Darquy S, Alyanakian MA, Simoneau G, et al. Effects of seven potential probiotic strains on specific immune responses in healthy adults: a double-blind, randomized, controlled trial. FEMS Immunol Med Microbiol. 2008 Jun; 53(1):107-13.
50. Ringel-Kulka T, Goldsmith JR, Carroll IM, Barros SP, Palsson O, Jobin C et al. Lactobacillus acidophilus NCFM affects colonic mucosal opioid receptor expression in patients with functional abdominal pain a randomised clinical study. Aliment Pharmacol Ther. 2014 Jul;40(2):200–207.
51. EFSA Panel on Dietetic Products, Nutrition and Allergies (NDA)2. Scientific Opinion on the substantiation of health claims related to lactase enzyme and breaking down lactose (ID 1697, 1818) pursuant to Article 13(1) of Regulation (EC) No 1924/20061. EFSA Journal 2009; 7(9):1236.
52. Kazemian H, Ghafourian S, Sadeghifard N, Houshmandfar R, Badakhsh B, Taji A, Shavalipour A, Mohebi R, Ebrahim-Saraie HS, Houri H, Heidari H. In vivo Antibacterial and Wound Healing Activities of Roman Chamomile (Chamaemelum nobile). Infect Disord Drug Targets. 2018;18(1):41-45.
53. Jang SH, Yang DK. The combination of Cassia obtusifolia L. and Foeniculum vulgare M. exhibits a laxative effect on loperamide- induced constipation of rats. PLoS One. 2018 Apr 5;13(4):e0195624.
54. Bellassoued K, Ben Hsouna A, Athmouni K, van Pelt J, Makni Ayadi F, Rebai T, et al. Protective effects of Mentha piperita L. leaf essential oil against CCl(4) induced hepatic oxidative damage and renal failure in rats. Lipids Health Dis. 2018 Jan 9;17(1):9.
55. Chobotova K, Vernallis AB, Majid FAA. Bromelain’s activity and potential as an anti-cancer agent: current evidence and perspectives.Cancer Letters. 2010;290(2):148–156.
56. Bartosch S, Woodmansey EJ, Paterson JC, McMurdo ME, Macfarlane GT. Microbiological effects of consuming a synbiotic containing Bifidobacterium bifidum, Bifidobacterium lactis, and oligofructose in elderly persons, determined by real-time polymerase chain reaction and counting of viable bacteria. Clin Infect Dis. 2005 Jan 1;40(1):28-37.
57. Turner RB, Woodfolk JA, Borish L, Steinke JW, Patrie JT, Muehling LM, et al. Effect of probiotic on innate inflammatory response and viral shedding in experimental rhinovirus infection – a randomised controlled trial. Benef Microbes. 2017;8:207–215.
58. West NP, Horn PL, Pyne DB, Gebski VJ, Lahtinen SJ, Fricker PA et al. Probiotic supplementation for respiratory and gastrointestinal illness symptoms in healthy physically active individuals Clin Nutr.2014;33(5): 581-587.
59. Sommer A, Katz J, Tarwotjo I. Increased risk of respiratory disease and diarrhea in childen with preexisting mild vitamin A deficiency. Am J Clin Nutr. 1984; 40: 1090-1095.
60. Sabetta JR, DePetrillo P, Cipriani RJ, Smardin J, Burns LA, Landry ML. Serum 25-hydroxyvitamin d and the incidence of acute viral respiratory tract infections in healthy adults. PLoS One. 2010 Jun 14;5(6):e11088.
61. Meydani SN, Han SN, Wu D. Vitamin E and immune response in the aged: molecular mechanism and clinical implications. Immunol Rev. 2005; 205: 269-284.
62. Walker EM, Walker SM. Effects of iron overload on the immune system. Ann Clin Lab Sci. 2000; 30: 354-365.
63. Calder PC, Kew S. The immune system: a target for functional foods? Br J Nutr. 2002; 88(2): S165-76.
64. Klotz LO, Kröncke KD, Buchczyk DP, Sies H. Role of copper, zinc, selenium and tellurium in the cellular defense against oxidative and nitrosative stress. J Nutr. 2003 May;133(5 Suppl 1):1448S-51S.
65. EFSA Panel on Dietetic Products, Nutrition and Allergies (NDA)2, 3. Scientific Opinion on the substantiation of health claims elated to various food(s)/food constituents(s) and “immune function/immune system” (ID 433, 605, 645, 791, 1384, 1451, 1624, 1743,1776, 1838, 1851, 1854, 1891, 1895, 3074, 3191, 3211, 3218, 3336, 3341, 3450, 3514, 3658, 3756, 3802, 3805, 3841, 3935, 3979), “contribution to body defences against external agents” (ID 2344, 3208, 3213, 3270, 3278, 3285, 3294, 3309, 3387, 3424, 3428, 3536, 3537, 3539, 3575, 3577, 3579, 3582, 3603, 3618, 3755, 3776, 3777, 3778, 3801, 3804, 3840, 4367, 4472), reduction of inflammation (ID 1327, 1391) and decreasing potentially pathogenic gastro-intestinal microorganisms (ID 2362, 2730, 4064) pursuant to Article 13(1) of Regulation (EC) No 1924/20061. EFSA Journal 2010;8(10):179




