| |
LOS ANÁLOGOS DEL RECEPTOR DE GLP-1 EN EL TRATAMIENTO DE LA DIABETES
La prevalencia estimada de diabetes mellitus tipo 2 (DM2) en nuestro país es de un 13.8%(1). Se ha demostrado que el control intensivo de los diferentes factores de riesgo cardiovascular que acompañan a la DM2, fundamentalmente si se realiza en fases tempranas, determina una estimable reducción en la aparición y progresión de las complicaciones micro y macroangiopáticas(2). En este sentido, existe cada vez un mayor número de documentos de consenso que abogan por no centralizar exclusivamente en los niveles de hemoglobina glicosilada (HbA1c) los objetivos de control en los pacientes con DM2, adquiriendo cada vez más importancia aspectos como la regulación de las glucemias basal y postprandial y la reducción de las hipoglucemias o la consecución de una pérdida ponderal adecuada(3).
 Doctor Ignacio Llorente Gómez Doctor Ignacio Llorente Gómez
Fuente: Dr. Llorente Gómez
El tratamiento farmacológico de la DM2 ha experimentado una gran transformación en la última década debido a la aparición de distintos grupos farmacológicos que actúan sobre los diferentes mecanismos implicados en la fisiopatología de la diabetes(4). En este sentido, los denominados agonistas del receptor del péptido similar al glucagón tipo 1 (AR GLP-1) constituyen una novedosa y atractiva opción terapéutica.
En las personas sanas, el péptido similar al glucagón tipo 1 (GLP-1) se secreta en el intestino en respuesta a la ingesta y actúa reduciendo los niveles de glucosa, mediante el estímulo de la producción de insulina y la supresión de la de glucagón, de una manera dependiente de la glucosa, es decir, que su actividad desaparece cuando los niveles de glucemia bajan a un nivel determinado. Es asimismo muy interesante la capacidad de GLP-1 para inducir distintos efectos, denominados extrapancreáticos o extraglucémicos, entre los que se encuentra el retraso en el vaciamiento gástrico, la supresión del apetito y, en modelos in vitro, la inhibición de la apoptosis de las células beta pancráticas y la presencia de efectos de protección cardiovascular. El factor limitante del GLP-1 nativo radica en que es rápidamente metabolizado (en 2-3 minutos) por la acción del enzima dipeptidilpeptidasa-4, lo que impide su utilización terapéutica(5). Por este motivo, se han desarrollado como alternativa los AR GLP-1, que constituyen un grupo farmacológico capaz de mimetizar y prolongar los efectos del GLP-1 in vivo(6).
DIFERENCIAS ENTRE LOS ANÁLOGOS DEL RECEPTOR DE GLP-1
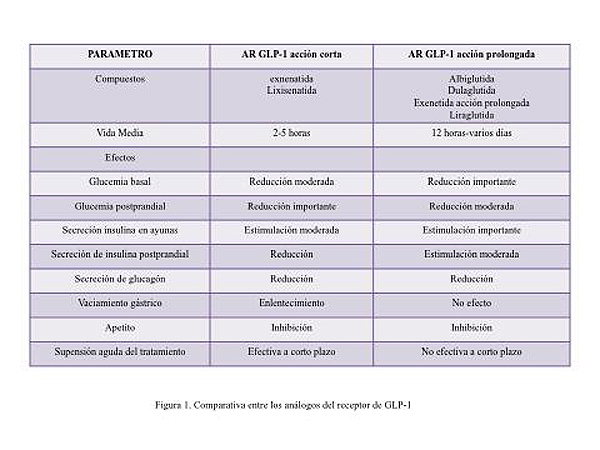
Los AR GLP-1 se clasifican en dos grupos, denominados de acción corta y de acción prolongada, entre los que existen diferencias estructurales y farmacocinéticas(7). Las diferencias quedan especificadas en la figura 1.
Los AR GLPI-1 de acción corta son exenatida y lixisenatida y los de acción prolongada albiglutida, dulaglutida, exenatida de liberación prolongada y liraglutida. Los AR GLP-1 de acción corta se caracterizan por fluctuaciones amplias de los niveles de péptido en sangre cuando se administran a los intervalos habituales (exenatida dos veces al día o lixisenatida una vez al día), mientras que el tratamiento con los de acción prolongada (administrados una vez al día como liraglutida o una vez a la semana como el resto) determina una activación suprafisiológica y continua de los receptores de GLP-1. Estas diferencias farmacocinéticas entre los agonistas de acción corta y prolongada tienen implicaciones fundamentales sobre su modo de acción, su eficacia y su tolerabilidad(8).
 Estructura de la insulina
Estructura de la insulina
Autor/a de la imagen: Computer Graphics Laboratory,
University of California, San Francisco /
Cargado por Роман Беккер
Fuente: Wikimedia Commons
Los AR GLP-1 de acción corta ejercen un interesante efecto reductor sobre la glucemia postprandial (GPP). El impacto de la GPP sobre el control de la diabetes y sus complicaciones no ha sido totalmente elucidado, pero existen evidencias de que puede jugar un papel significativo al constituir una factor de riesgo independiente para la aparición de eventos cardiovasculares y ser factor de predicción de mortalidad por cualquier causa, con un impacto muy superior al de la glucemia en ayunas. Es importante recordar que la GPP tiene una influencia mayor cuando los niveles de HbA1c no son muy elevados, es decir, inferiores a 7.5%. Los AR GLP-1 de acción corta determinan una reducción importante de la GPP, si bien el mecanismo no es mediado por la estimulación de la secreción de insulina post ingesta, que curiosamente se encuentra disminuida tras las administración de este grupo terapéutico, sino que se ha descrito como principal mecanismo implicado el retraso del vaciamiento gástrico y el consiguiente aumento de la absorción de la glucosa esplácnica. La inhibición de la secreción de glucagón juega un papel, si bien es secundario(9). Por el contrario, tras la administración de los AR GLP-1 de acción prolongada existe un incremento en los niveles de insulina postprandial(6). Esta diferencia entre los AR GLP-1 de acción corta y acción prolongada sugiere un efecto superior de los primeros cuando el objetivo es la reducción de las excursiones de glucemia postprandial en el tratamiento de la DM2, tal y como ha sido publicado en un grupo de pacientes con HbA1c inferior a 7.5%(11).
Una reciente revisión de los ensayos clínicos “head to head” entre AR GLP-1 muestra la mayor parte de los ensayos en los que se comparan directamente en concepto de eficacia y seguridad. Cabe destacar que no todos los ensayos se realizaron en las mismas condiciones ni con el mismo tipo de pacientes y que, fundamentalmente, los niveles de HbA1c iniciales difirieron de manera sustancial(12). Como conclusión puede extraerse que las reducciones de HbA1c son similares entre los diferentes AR GLP-1, si bien es primordial en la interpretación de los resultados los diferentes mecanismos de acción que presentan los análogos de acción corta y de acción prolongada.
Otro efecto a destacar de los AR GLP-1 de acción corta es su acción supresora del apetito. Durante algún tiempo se ha atribuido ese efecto al retraso inducido por este grupo farmacológico en el vaciamiento gástrico. Teniendo en cuenta que los resultados obtenidos en reducción ponderal son muy similares y no inferiores a los del grupo de AR GLP-1 de acción prolongada y que estos últimos no parecen tener un efecto sustancial sobre la motilidad gástrica cuando se administran de forma crónica, debe inferirse que este efecto de reducción de peso está mediado principalmente por sus acciones directas sobre los receptores del hipotálamo y otras áreas del SNC(13).
Finalmente, un aspecto a considerar es la viabilidad de la suspensión del tratamiento en caso de ser necesaria ante determinadas circunstancias clínicas, como una pancreatitis aguda o una cirugía abdominal no programada y que implican una suspensión temporal del mismo(6). La retirada con los AR GLP-1 de acción prolongada debe ser programada con antelación, por la persistencia de sus efectos tras la suspensión, aspecto que no es necesario tener en cuenta con los compuestos de acción corta.
APORTACIONES DE LIXISENATIDA EN EL TRATAMIENTO DE LA DIABETES TIPO 2
Lixisenatida es un AR GLP-1 de acción corta que ha demostrado su eficacia en la disminución de HbA1c y la consecución de objetivos de control glucémico sin aumentar el riesgo de hipoglucemia. Su principal efecto lo ejerce sobre las excursiones de glucemia postprandial. En comparación con exenatida de acción corta presenta unos resultados de eficacia similares, con la ventaja de producir menos efectos secundarios. Asimismo induce una reducción ponderal semejante los AR GLP-1 de acción prolongada, a través de un efecto directo inhibidor del apetito(14).
Existen diferentes escenarios en los que el uso de lixisenatida puede aportar beneficios en el tratamiento de la DM 2. En primer lugar debe valorarse su asociación precoz a metformina en pacientes diabéticos de corta evolución con un índice de masa corporal (IMC) mayor de 30 Kg/m2 y con control glucémico no optimizado (HbA1c >6,5-7%). Lixisenatida presenta un efecto sinérgico con metformina y permite un estricto control glucémico precoz sin la presencia de hipoglucemias, asociando a este efecto una reducción ponderal significativa, no objetivada en tratamiento combinado de metformina con sulfonilureas o pioglitazona(14).
Sin embargo, su utilización es aún más beneficiosa en pacientes con IMC superior a 30 Kg/m2 y que se encuentran en tratamiento con insulina basal, sin haber logrado los objetivos de control glucémico establecidos en cada caso, a pesar de presentar glucemias basales adecuadas. Esta estrategia denominada ” insulina más incretina”, está basada en la combinación de fármacos con efecto incretínico e insulina basal y ha demostrado diferentes beneficios en el tratamiento de la DM2, que son mucho más relevantes cuando asociamos a la insulina basal AR GLP-1 de acción corta(15).
 Autor/a: Cíntia Martins
Autor/a: Cíntia Martins
Fuente: www.freeimages.com
Centrándonos en la combinación de lixisenatida más insulina basal, un reciente metaanálisis ha analizado los resultados de esta combinación frente a insulina basal más placebo (asociados o no a antidiabéticos orales). Comparado con insulina basal aislada, la combinación de lixisenatida más insulina determina una reducción significativa de la HbA1c, junto a una disminución también significativa de la dosis de insulina administrada, tanto en términos absolutos como en unidades por kilogramo de peso. Esta mejoría del control glucémico se basa en la reducción de la GPP, ya que no se objetivan diferencias significativas en los niveles de glucemia basal entre ambos grupos. Es importante resaltar que esta reducción de HbA1c es consistente y que se observa tanto en los pacientes que asociaron lixisenatida a insulina basal previa, como en aquellos que iniciaron el tratamiento combinado desde el principio, independientemente de que estuviesen tomando o no sulfonilureas. Además, el tratamiento de lixisenatida más insulina se acompaña de una reducción de peso significativa en comparación con el de insulina basal(16).
En definitiva, los mecanismos de acción de insulina basal y lixisenatida son complementarios, lo que les convierte en una combinación atractiva, fundamentalmente en aquellos pacientes en tratamiento previo con insulina basal y a los que se les debe intensificar el tratamiento, minimizando la esperada ganancia ponderal y reduciendo la mayor probabilidad de presentar hipoglucemias que tienen lugar si utilizamos una terapia basal bolo con insulina basal y análogos de insulina rápida o una terapia de múltiples dosis con insulinas premezcladas. Es importante establecer que el efecto de lixisenatida es más evidente si previamente existe un adecuado control de las glucemias basales(17).
En este sentido, están en desarrollo en este momento varios ensayos clínicos que evalúan la necesidad de revisar el algoritmo de tratamiento actual para los pacientes con DM2 y que requieren intensificación de su insulinoterapia basal. Estos ensayos serán publicados en breve. Nuestro grupo está realizando un estudio observacional en el que se compara la eficacia en términos de HbA1c, GPP y reducción ponderal, así como la presencia de hipoglucemias, de la combinación de lixisenatida e insulina basal en relación a la administración de 2 o 3 inyecciones de insulinas premezcladas. No obstante, las recomendaciones de la Asociación Americana de Endocrinólogos Clínicos (AACE) emitidas en el año 2015 ya aconsejan sobre la utilización de la combinación de AR GLP-1 de acción corta en el algoritmo de intensificación del tratamiento con insulina basal(18).
Bibliografía
1. Prevalence of diabetes mellitus and impaired glucose regulation in Spain: the Di@bet.es Study. Soriguer F, Goday A, Bosch-Comas A, et al. Diabetologia. 2012; 55: 88-93.
2. Gæde P, Lund-Andersen H, Parving HH, and Pedersen O. N Engl J Med 2008;358:580-91
3. Standards of Medical Care in Diabetes—2015. care.diabetesjournals.org/content/suppl/2014/12/23/38.Supplement_1.
4. From the Triumvirate to the Ominous Octet: A New Paradigm for the Treatment of Type 2 Diabetes Mellitus. Ralph A. De Fronzo. Diabetes 2009; 58: 773-795.
5. Nauck MA, Bartels E, Oskov C, Erbert R, Creutzfeld W. Additive insulinotropic effects of exogenous synthetic human gastric inhibitory polipeptide ans glucagon-like peptide -1 (7-36) amide infused at near-physiological insulinotropic hormone and glucose concentrations. J Clin Endocrinol Metab 1993; 76 (4): 912-17.
6. Meier JJ. GLP-1 receptor agonists for individualized treatment of type 2 diabetes mellitus. Nat Rev Endocrinol 2012; 8 (12): 728-42
7. Lund A, Knop FK, Vilsbol T. Glucagon-like peptide-1 receptor agonists for the treatment of type 2 diabetes. Differences and similarities. Eur J Intern Med 2014; 25 (5): 407-14.
8. Umapatysivam MM, Lee MY, Jones KL, et al. Comparative effects of prolonged and intermittent stimulation of-like peptide-1 receptor on gastric emptying and glycemia. Diabetes 2014; 63 (2): 785-90
9. Ahrén B, Gautier FJ, Berria R, Stager W, Aronson R, Bailey CJ. Pronounced reduction of postprandial glucagon by lixisenatide: a meta-analisis of randomized clinical trials. Diabetes Obes Metab 2014; 16 (9): 861-8
10. Quiazon CCL, Shomali ME. Lixisenatide-once-daily glucagon-like-peptide-1 receptor agonist in the management of type 2 diabetes. European Endocrinology 2012; 8(1): 12-7.
11. Kapitza C, Forst T, Coester HV, Poitiers F, Ruus P, Hincelin-Mery A. Pharmacodynamic characteristics of lixisenatide once daily versus liraglutide once daily in patients with type 2 diabetes insufficiently controlled on metformin. Diabetes Obes Metab 2013; 15(7): 642-9
12. GLP-1 receptor agonists: a review of head-to-head clinical studies. Trujillo JM, Nuffer W and Ellis SL. Ther Aadv Endocrinol Metab 2015; 6 (1): 19-28.
13. Turton MD, O´Shea D, Gunn I, et al. A role of glucagon-like peptide-1 in the central regulation of feeding. Nature 1996; 379: 69-72
14. Efficacy and safety of lixisenatide in the treatment of Type 2 diabetes mellitus: a review of Phase III clinical data. Raccah D. Expert Rev. Endocrinol. Metab. 8(2) doi: 10.1586/EEM.12.82 (2013) (Epub ahead of print)
15. Insulin plus incretin: A glucose-lowering strategy for type 2-diabetes. Ahrén B. World J Diabetes 2014 February 15; 5(1): 40-51.
16. Glucagon-like peptide-1 receptor agonists as insulin add-on therapy in patients with inadequate glycemic control in type 2 diabetes mellitus: lixisenatide as a new therapeutic option. Gómez-Huelgas R, Azriel S, Puig-Domingo M, Vidal J, de Pablos-Velasco P. Int J Pharmacol Ther 2014. doi: 10.5414/CP202052
17. Once-daily prandial lixisenatide versus once-daily rapid-acting insulin in patients with type 2 diabetes mellitus insufficiently controlled with basal insulin: analysis of data from five randomized, controlled trials. Raccah D, Lin J, Wang E, et al. J Diab Comp 2014; 28: 40–4.
18. AACE/ACE Comprehensive Diabetes Management Algorithm 2015. Handelsman Y, Bloomgarden ZT, Grunberger G et al. Endocr Pract. 2015; 21 (Suppl 1).
|
|