Redacción Farmacosalud.com
Los médicos no disponen de ninguna herramienta para detectar precozmente los pacientes de cáncer de mama que sufrirán metástasis en los huesos, un proceso que se producirá en el 15-20% de los enfermos. Y en particular, no pueden identificar a los pacientes que se podrían beneficiar anticipadamente de tratamientos específicos de metástasis, como el ácido zoledrónico. Un estudio[1] liderado por el profesor Robert E. Coleman, de la Universidad de Sheffield, y el investigador ICREA del Instituto de Investigación Biomédica (IRB Barcelona), Roger Gomis, publicado en ‘Lancet Oncology’, descubre la amplificación del gen MAF como una aproximación que permite estratificar a los pacientes de cáncer de mama que se beneficiarían del uso de ácido zoledrónico en un contexto adyuvante (pacientes negativos para MAF), de aquellos que les sería perjudicial (positivos para MAF y que no estén en postmenopausia). El descubrimiento original fue patentado y transferido a la empresa Inbiomotion del IRB Barcelona y ICREA, creada a finales de 2010. Inbiomotion, pilotada por la empresa de capital riesgo Ysios Capital y la Caixa Capital Risc, ha desarrollado la tecnología necesaria para validar el marcador en estudios clínicos.
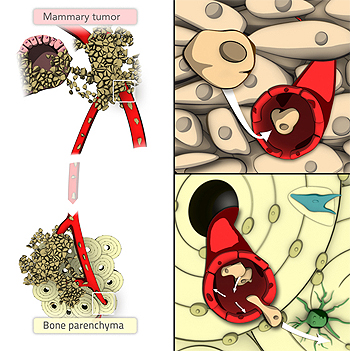
Gráfico de metástasis de un tumor primario de mama a huesos
Autor de la imagen: Formas Naturales para Inbiomotion, IRB Barcelona
Fuente: IRB Barcelona
Las metástasis óseas son el único tipo de metástasis que disponen de tratamientos que, aunque sin curarlas, las mantiene controladas. Ahora bien, la terapia sólo se administra una vez la metástasis se manifiesta y suele ser demasiado tarde. Estudios preliminares indican que los mismos fármacos para tratarlas serían igualmente válidos para evitarlas, por ello identificar los pacientes que podrían beneficiarse de los fármacos es clave. "Es aquí donde este descubrimiento del IRB Barcelona, validado por este estudio en ‘Lancet Oncology’ puede ser de gran utilidad para la clínica y evitaría el tratamiento de pacientes que no se beneficiarían o que podrían salir perjudicados", sugiere Gomis, jefe del laboratorio Control de Crecimiento y Metástasis.
Aproximadamente, hay un millón de nuevos casos de tumor mamario al año. El tratamiento preventivo contra las metástasis al hueso puede tener efectos secundarios indeseables y un coste elevado; por tanto, no se puede administrar masivamente, cuando ya se sabe que podría ser perjudicial para el 4% de los pacientes. "Para implementar un test diagnóstico de acompañamiento a un tratamiento, primero hay que saber qué pacientes pueden beneficiarse de él y cuáles no. Nuestro descubrimiento ofrece un modo de distinguirlos, cuando antes no era posible", confirma Gomis.

El científico Roger Gomis, investigador ICREA del Instituto de Investigación Biomédica (IRB Barcelona) y jefe del Laboratorio Control de Crecimiento y Metátasis
Fuente: IRB Barcelona
Este estudio se ha centrado en la asociación entre el beneficio del tratamiento, la amplificación del gen MAF y el resultado final. En pacientes MAF-negativos, la inclusión de ácido zoledrónico en el contexto adyuvante se asocia con mejores resultados, independientemente del estado de la menopausia. En cambio, en pacientes con MAF-positivo no postmenopáusicas en el inicio del tratamiento, observan un aumento de resultados adversos y mortalidad. La evaluación en función de MAF tiene el potencial de convertirse en un enfoque objetivo para seleccionar pacientes con cáncer de mama al que administrar un tratamiento adyuvante con bisfosfonato (es decir, ácido zoledrónico).
Joan Albanell, jefe de Oncología Médica del Hospital del Mar, afirma: "El estudio presenta evidencias nuevas para apoyar MAF como el primer biomarcador predictivo con aplicación clínica para seleccionar pacientes con cáncer de mama temprano para recibir tratamiento adyuvante de ácido zoledrónico. Si los resultados se confirman en un estudio independiente, MAF debería incorporarse a pruebas rutinarias en el cáncer de mama temprano y tendría un impacto en la vida de miles de pacientes que se beneficiarían de una selección personalizada". El próximo paso es confirmar el hallazgo en un ensayo independiente. De confirmarse, se podría modificar la estrategia terapéutica del tumor mamario inicial y mejorar la calidad de vida de estos pacientes. "Esto es exactamente lo que estamos haciendo ahora. Inbiomotion ha completado el desarrollo de la tecnología y ha iniciado el segundo estudio clínico prospectivo/retrospectivo para validar el marcador en pacientes con cáncer de mama inicial", explica Gomis.
El conocimiento publicado en open acces en ‘Lancet Oncology’, una de las revistas especializadas en oncología más leída, es uno de los proyectos de transferencia de tecnología del IRB Barcelona. El hallazgo dio lugar a la compañía Inbiomotion, fundada por Gomis y participada también por ICREA. La spin off recibió financiación en 2012 y 2016 del fondo de capital riesgo Ysios Capital, la Caixa Capital Risc y la Fundación Vila Casas, para desarrollar las herramientas para realizar los ensayos clínicos. La investigación se ha llevado a cabo en colaboración con varios centros clínicos en Europa, incluyendo el Hospital del Mar con el Dr. Joan Albanell, la Fundación Jiménez Díaz con el Dr. Federico Rojo, el IRB Barcelona con el Dr. Roger Gomis y el Centro de Investigación del Cáncer de Sheffield con Robert E. Coleman, experto mundial en metástasis óseas, y Inbiomotion con el Dr. Juan Carlos Tercero y el Dr. Joël Jean-Mairet. El laboratorio del Dr. Roger Gomis cuenta con financiación de la Fundación BBVA, el Ministerio de Economía y Competitividad y la Generalitat de Catalunya.
Descubierto un mecanismo de resistencia a trastuzumab-emtansina
Por otra parte, investigadores del Centro de Investigación Biomédica en Red de Cáncer (CIBERONC) en el Centro de Investigación del Cáncer de Salamanca, el Hospital Clínico Universitario de Albacete y el Vall d’Hebron Instituto de Oncología (VHIO) han descrito un nuevo mecanismo de resistencia al fármaco trastuzumab-emtansina (T-DM1) en cáncer de mama. El estudio,[2] fruto de la colaboración entre los grupos de investigación liderados por los doctores Atanasio Pandiella, Alberto Ocaña y Joaquín Arribas, se ha publicado en la revista ‘Cancer Research’.
El T-DM1 es un fármaco del tipo Conjugados Anticuerpo-Fármaco (ADC, por sus siglas en inglés “Antibody-Drug Conjugate”) que se usa para tratar tumores HER2 positivos. Estos tumores representan aproximadamente un 20% de todos los tumores mamarios, que responden bien a terapias anti-HER2, basadas en trastuzumab o en inhibidores de la actividad quinasa de HER2. Sin embargo, en ocasiones estas terapias fallan o las pacientes dejan de responder. Debido a esto, se desarrolló T-DM1, un derivado de trastuzumab al cual se encuentran unidas moléculas del potente agente antimicrotubular DM1. El T-DM1 se utiliza para el tratamiento de pacientes refractarias a los tratamientos anti-HER2 más convencionales.
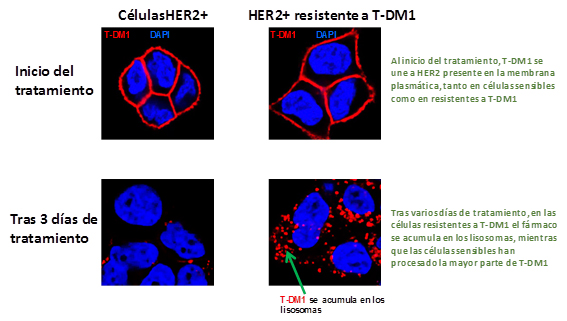
Fuente: CIBERONC / Centro de Investigación Biomédica en Red (CIBER)
A pesar de que T-DM1 muestra eficacia, con el tiempo se desarrollan resistencias a T-DM1. El objetivo de este estudio se centró en descubrir el origen de tales resistencias para luchar contra ellas. En el trabajo, los investigadores del CIBERONC describen uno de los mecanismos de escape que pueden presentar las células tumorales de mama HER2+ para evitar la acción de T-DM1. Tal mecanismo se basa en un déficit de la función proteolítica de los lisosomas. De hecho, la acción antitumoral de T-DM1 requiere su internalización y degradación dentro de los lisosomas, gracias a la actividad de proteinasas ácidas presentes en esas organelas.
Los autores de la investigación aislaron células resistentes a T-DM1 para estudiarlas, y observaron que sus lisosomas presentan un pH más alcalino de lo habitual, lo cual dificulta la función de las proteasas lisosomales. “Este hallazgo abre las puertas al potencial uso de acidificadores lisosomales para mejorar la eficacia de T-DM1”, explica Atanasio Pandiella, co-coordinador del Programa de Investigación en Cáncer de Mama del CIBERONC. La publicación también describe la existencia de otros mecanismos independientes de la alteración del pH lisosomal. Actualmente se están llevando a cabo estudios para caracterizar esos mecanismos. “En conjunto, estos estudios de resistencia a T-DM1 podrían facilitar la optimización del uso de ese fármaco en pacientes con cáncer de mama HER2+. Es más, el trabajo publicado puede ofrecer pistas acerca de los mecanismos generales de resistencia a ADCs, más allá de T-DM1”, explica el investigador. De hecho, se postula que otros ADCs que utilicen la misma vía de internalización y degradación de T-DM1 podrían perder eficacia si las células diana carecen de una función proteolítica lisosomal adecuada.
La ecografía automática en 3D de mama (ABUS)
Por otro lado, la ecografía automática 3D de mama es una tecnología de ultrasonidos que no emite radiación ni causa dolor y que está especialmente indicada para realizar pruebas en mamas densas, es decir, aquellas en las que hay un mayor volumen de tejido mamario que grasa. El sistema ABUS consta de una base de ecógrafo con ruedas dotado de un brazo adaptable con un cabezal en su zona distal. Este cabezal lleva instalado un transductor de 15 cm de zona útil (los transductores tradicionales ecográficos son de tan solo 3 centímetros) que se coloca sobre la mama de la paciente en decúbito supino. El transductor posee una forma anatómica que se adapta a la forma de la mama.

La ecografía automática en 3D de mama (ABUS)
Fuente: GE Healthcare / Hospital Quirónsalud / Docor Comunicación
Gracias al transductor, mucho más grande que el que incorporan los ecógrafos habituales y con forma anatómica, el ABUS se adapta a la forma de la mama y genera una imagen tridimensional. Esto puede permitir al radiólogo analizar la lesión simultáneamente en planos transversal y coronal, y navegar por las imágenes de forma interactiva. Según estudios realizados por la compañía GE Healthcare, combinando tecnologías como la mamografía y la ecografía 3D automática, la posibilidad de localizar cánceres invasivos en mamas densas tiene un incremento relativo del 55% si se compara la mamografía solamente.[3]
Referencias
1. Coleman RE, Hall A, Albanell J, Hanby A, Bell R, Cameron D, Dodwell D, Marshall H, Jean-Mairet J, Tercero JC, Rojo F, Gregory W, and Gomis RR. Effect of MAF Amplification donde treatment outcomes with adyuvante zoledrónico ácido in early breast cancer: a secondary analysis of the Internation, open-label, randomised, controlled, phase 3 AZURE (BIG 01/04) Lancet Oncology (2017) Doi: 10.1016 / S1470-2045 (17) 30603-4
2. Resistance to the Antibody-Drug Conjugate T-DM1 Is Based in a Reduction in Lysosomal Proteolytic Activity. Ríos-Luci C, García-Alonso S, Díaz-Rodríguez E, Nadal-Serrano M, Arribas J, Ocaña A, Pandiella A. Cancer Res. 2017 Sep 1;77(17):4639-4651. doi: 10.1158/0008-5472.CAN-16-3127. Epub 2017 Jul 7.
3. Brem RF, Tabár L, et.al. Assessing Improvement in Detection of Breast Cancer with Three-dimensional Automated Breast US in Women with Dense Breast Tissue: The somoInsight Study. Radiology.2015 Mar; 274(3): 663-73




