Dra. Marta Ferrándiz Mach. Unidad del Dolor Consultor II del Servicio de Anestesiología del Hospital de la Santa Creu i Sant Pau (Barcelona)
Dr. Víctor Mayoral Rojals. Unidad del Dolor. Servicio de Anestesiología del Hospital Universitario de Bellvitge (Barcelona)
![]()
Coordinadora científica: Dra. Elena Català. Directora de la Unidad del Dolor Hospital de la Santa Creu i Sant Pau (Barcelona)

Dra. Marta Ferrándiz Mach
El dolor neuropático (DN) es un tipo común de dolor crónico en el cual el 60% de los pacientes pueden presentar sintomatología neuropática localizada y afecta a un área específica y circunscrita del cuerpo (1).
El diagnóstico en fases tempranas del DN es a menudo un reto para los profesionales de la Atención Primaria. Los médicos de atención primaria son el punto de acceso al sistema sanitario. El dolor es la mayor causa de consulta en la atención primaria en los países occidentales, representando un 40% de las mismas. Un 20% de estos pacientes han sufrido dolor durante más de 6 meses, y únicamente de un 40-60% de ellos van a obtener un alivio parcial de su dolor (2).
Las patologías que cursan con dolor neuropático (DN) expresan múltiples combinaciones de signos y síntomas positivos o negativos que, por sí solos y aisladamente, no deberían considerarse como diagnóstico de DN. Así, las herramientas clínicas de sospecha diagnóstica en formato cuestionario como el Pain-Detect (3), la Leeds Assessment of Neuropathic Symptoms and Signs [LANSS] (4) y la Douleur Neuropatique 4 [DN4] (5), entre las más utilizadas, agrupan los síntomas o signos de DN más sensibles y específicos conocidos para mejorar la sensibilidad y especificidad.

Dr. Víctor Mayoral Rojals
Sin embargo, estos cuestionarios no tienen en cuenta el concepto de dolor neuropático localizado (DNL) [“área circunscrita de máximo dolor, asociado con signos sensitivos positivos o negativos, y/o sintomatología espontánea neuropática característica del DN”] (1), ni siguen los pasos del proceso de menor a mayor probabilidad diagnóstica propuesto por Treede y col para DN (6-7).
Hasta hace poco tiempo, no existía un procedimiento diagnóstico específico y estandarizado para ese tipo de dolor neuropático localizado (DNL), el cual no está ocasionado por un DN central ni tampoco tiene un desencadenante central. De este modo, los pacientes podían seguir una escalada terapéutica durante meses o incluso años, sin obtener beneficio alguno. Para dirigir y resolver estos problemas, se creó hace algunos años un grupo internacional de expertos formado por asesores especialistas en dolor, seleccionados por su experiencia clínica e investigadora (2,8).
Algoritmo de Diagnóstico
Con el fin de dar una respuesta a las carencias de los cuestionarios clásicos para el diagnóstico de DN y con el objetivo de construir una herramienta de detección rápida y fácil de implementar, se desarrolló la Herramienta de Detección de Dolor Neuropático Localizado (DNL). Como premisa, se estipuló que esta Herramienta debería ser fácil de comprender, fácil de llevar a cabo y que no consumiera mucho tiempo del profesional que la ponía en práctica2. La herramienta tiene un formato de “tarjeta de bolsillo” (9 cm x 14 cm: A6) y consiste en 4 preguntas de selección. La tarjeta adicionalmente proporciona ejemplos de test diagnósticos confirmando la existencia de lesiones nerviosas o enfermedades con DN subyacente (Figura 1).
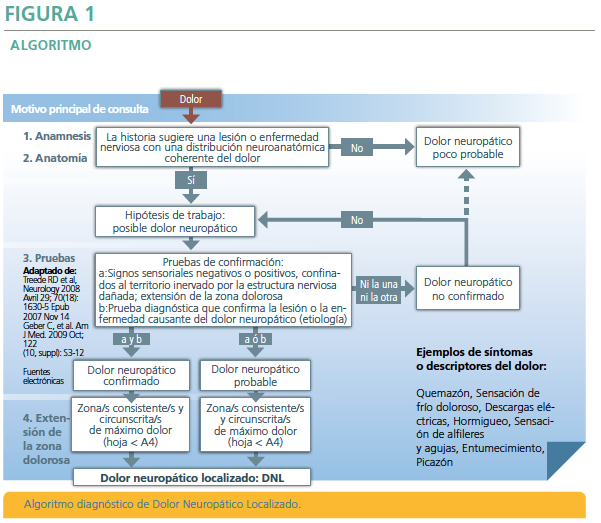

Los grados de probabilidad se obtienen dependiendo de las respuestas dadas a 4 preguntas que se deben contestar de una manera consecutiva (Figura 2) y no precisa más que una historia clínica que incluya una adecuada exploración neurológica.

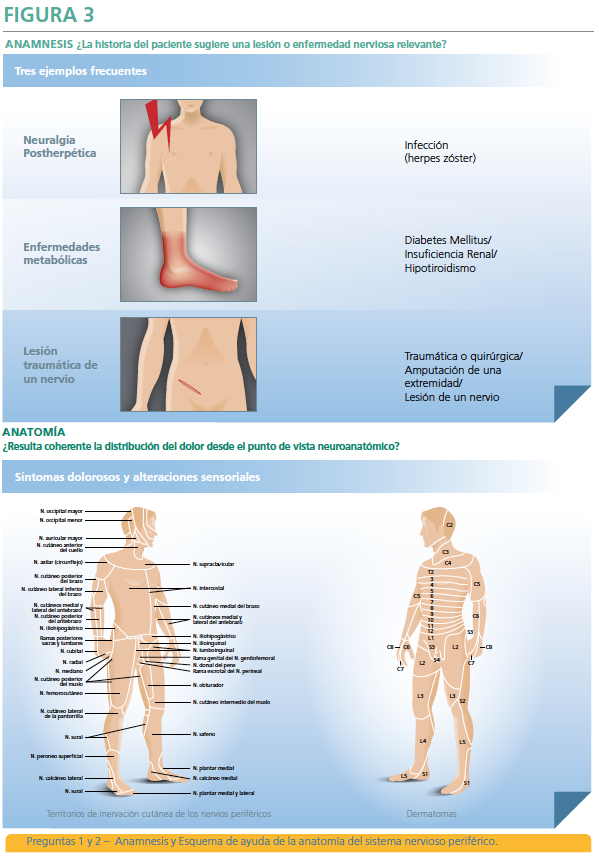
La herramienta también proporciona información orientada a la confirmación diagnóstica de DNL que requiere de una prueba diagnóstica que demuestre la lesión neurológica o enfermedad causante (radiológica, estudio de conducción nerviosa, biopsia o pruebas analíticas orientadas a la enfermedad de base), así como criterios de derivación al especialista que también resultan de utilidad. - Las 2 primeras preguntas se refieren a la historia clínica del dolor del paciente (una lesión o enfermedad nerviosa relevante como por ejemplo un antecedente de infección por herpes zóster en la zona de dolor), junto con una distribución neuroanatómica coherente, con documentación del área dolorosa, de los síntomas dolorosos y de las alteraciones sensitivas (síntomas positivos y/o negativos en la distribución de una o más metámeras para una neuralgia postherpética, por ejemplo). Si se contesta con un sí a estas dos preguntas, ello conduce a la hipótesis de trabajo de un “posible Dolor Neuropático”, el cual será entonces analizado por una exploración física (Figura 3).
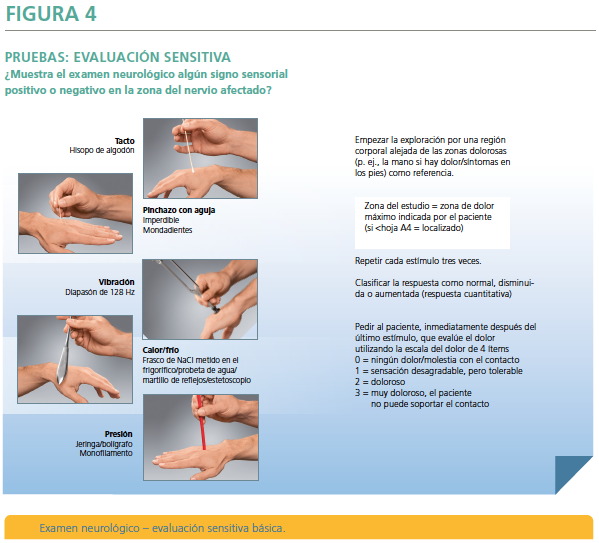
- La tercera pregunta (Figura 2 y Figura 4) se asocia a las explicaciones de cómo llevar a cabo los tests sensitivos más simples. Esta pregunta está encaminada a considerar que el “Dolor Neuropático probable”. Se debe contestar tras realizar una exploración neurológica básica donde se detecte algún signo sensorial positivo o negativo en la zona neuroanatómíca coherente. Para ello, exploraremos las diferentes fibras nerviosas del sistema somatosensorial con instrumentos básicos: “tacto” con hisopo de algodón; “pinchazo con aguja” con un imperdible o un mondadientes; “vibración” con un diapasón; “calor/frío” con una probeta con agua; “presión” con una jeringa o bolígrafo, o con monofilamentos de von frey. Se compara con el lado contralateral y se empieza por zonas alejadas del dolor pidiendo al paciente que valore tras 3 estímulos repetidos, si la sensación percibida es normal, disminuida o aumentada. Se recomienda también, y con el fin de detectar áreas de alodinia, que el paciente valore la intensidad del estímulo como no molesto, desagradable y doloroso o muy doloroso (no puede soportar el contacto). Si además se realiza una prueba diagnóstica que confirme la lesión o la enfermedad causante del DN, el DN se considerará como “Dolor Neuropático confirmado”.
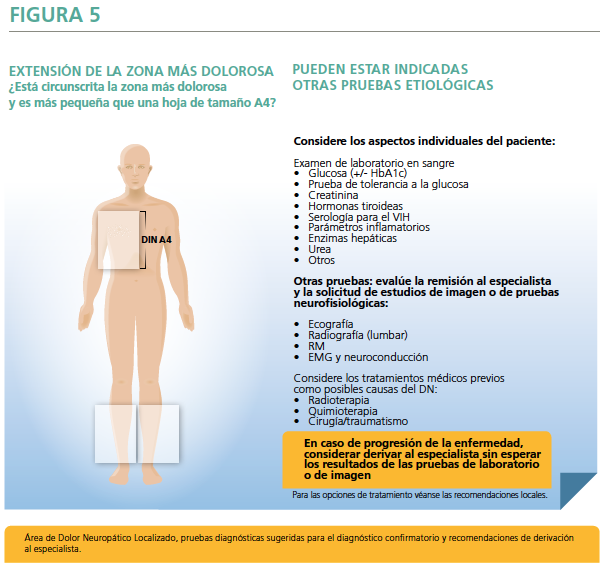
- Finalmente, y fieles a la definición de DNL, en la pregunta Nº 4 se hace referencia a que la zona con dolor debe ser de un tamaño orientativo menor a lo que sería una hoja de DIN A4 y lo que resulta más importante, que la zona de máximo dolor sea consistente y circunscrita (Figura 5). Siguiendo el algoritmo, el diagnóstico de DNL únicamente puede ser considerado en las presentaciones clínicas en las que el diagnóstico de DN sea “confirmado” o “probable”. En estas dos subdivisiones, puede ser posible que el dolor sea localizado a un área correspondiente a una lesión o enfermedad que afecte topográficamente a una parte definida y/o circunscrita (9).
Para verificar la utilidad de la Herramienta Diagnóstica se utilizó en 2079 pacientes con dolor crónico visitados por médicos de familia en atención primaria (entre Noviembre del 2012 y Marzo del 2013). Dichos facultativos expresaron que la herramienta era útil o muy útil y que facilitaba su práctica clínica en el 96,8% de los casos.
Encontraron utilidad en el 94,5% de los pacientes con DN y en el 94,3% de los pacientes con DNL. Utilizaron 7 minutos (media entre 5-10’) en llevar a cabo el diagnóstico utilizando la herramienta, incluyendo la exploración sensitiva6. Siguiendo el algoritmo de detección de DNL (Figura 1), y comprobado por especialistas en dolor, la herramienta detectó un 55,3% de pacientes con DNL entre los que tenían DN, similar a lo comunicado en la literatura (2,8). En condiciones de práctica clínica diaria, la sensibilidad y especificidad de la herramienta para la detección de DNL fue del 46,7 % y 86,6 %, respectivamente.
El DN aunque mucho menos frecuente que el dolor nociceptivo es de más difícil diagnóstico y tratamiento, y empeora con mayor frecuencia la calidad de vida de los pacientes. El DN con síntomas localizados en muchas ocasiones requerirá de un régimen terapéutico específico, que con frecuencia suelen manejar los especialistas en dolor (10). Esta herramienta de selección es fácil de realizar y útil para detectar DN y DNL en pacientes con dolor crónico en atención primaria.
Esta herramienta, el primer instrumento de detección basado en el algoritmo de la IASP (International Association for the Study of Pain), podría ser utilizado para una rápida valoración de los pacientes con dolor crónico, por los profesionales de atención primaria en su práctica diaria, y como una herramienta de ayuda en el inicio de su estrategia terapéutica.

Bibliografía
1.Mick G, Baron R, Finnerup NB, Hans G, Kern K-U, Brett B, et al. What is localized neuropathic pain? A first proposal to characterize and define a widely used term. Pain Manag 2012;2:71–7.
2.Mick G, Baron R, Correa- Illanes G, Hans G, Mayoral V, Frías X, et al. Is an easy and reliable diagnosis of localized neuropathic pain (LNP) possible in general practice? Development of a screening tool based on IASP criteria. Curr Med Res Opin 2014;3:1357–66.
3.de Andrés J, Pérez-Cajaraville J, Lopez-Alarcón MD, López-Millán JM, Margarit C, Rodrigo-Royo MD, et al. Cultural adaptation and validation of the pain- DETECT scale into Spanish. Clin J Pain 2012;28:243– 53.
4.Pérez C, Gálvez R, Insausti J, Bennett M, Ruiz M, Rejas J, et al. [Linguistic adaptation and Spanish validation of the LANSS (Leeds Assessment of Neuropathic Symptoms and Signs) scale for the diagnosis of neuropathic pain]. Medicina Clínica 2006;127:485–91.
5.Pérez C, Gálvez R, Huelbes S, Insausti J, Bouhassira D, Díaz S, et al. Validity and reliability of the Spanish version of the DN4 (Douleur Neuropathique 4 questions) questionnaire for differential diagnosis of pain syndromes associated to a neuropathic or somatic component. Health Qual Life Outcomes 2007;5:66.
6.Treede RD, Jensen TS, Campbell JN, Cruccu G, Dostrovsky JO, Griffin JW, et al. Neuropathic pain: redefinition and a grading system for clinical and research purposes. Lippincott Williams & Wilkins; 2008. pp. 1630–5.
7.Treede RD, Jenssen TS, Campbell JN et al. Neuropathic pain redefinition and a grading system for clinical and research purposes. Neurology 2008; 70: 1630-1635.
8.Allegri M, Baron R, Hans G, Correa-Illanes G, Mayoral Rojals V, Mick G, et al. A pharmacological treatment algorithm for localized neuropathic pain. Curr Med Res Opin 2016;32:377–84.
9.Casale R, Mattia C. Building a diagnostic algorithm on localized neuropathic pain (LNP) and tarjeted topical treatment: focus on 5% lidocaine-medicated plaster. Therapeutics and Clinical Risk Management 2014;
10: 259-268 10.de Leon Casasola O, Mayoral V. The topical 5% lidocaine medicated plaster in localized neuropathic pain: a reappraisal of the clinical evidence. J of Pain Research 2016; 9: 67-79





